
19.(10分) 容积固定的密闭容器中,发生可逆反应:M(g)+N(g)  2P(g)+Q(g) ΔH>0,
2P(g)+Q(g) ΔH>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N 的浓度是 ,P 的体积分数为_________。
(2)若反应温度升高,M的转化率____________ (填“增大”“减小”或“不变”,下同),平均相对分子质量____________,混合气体密度____________。
班级 姓名
18.(12分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)  CH3OH(g),不同温度时甲醇的物质的量随时间变化曲线如下图所示。根据题意完成下列各题:
CH3OH(g),不同温度时甲醇的物质的量随时间变化曲线如下图所示。根据题意完成下列各题:
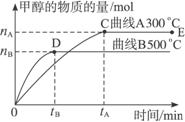
(1)反应达到平衡时,升高温度,v正_____________ (填“增大”“减小”或“不变”)。化学平衡向 移动
(2)500 ℃,从反应开始到平衡,H2的反应速率v(H2)=________________________。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是_____________。
A.氢气的浓度减小 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是__________________________(用化学方程式表示)。
17. (12分)反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
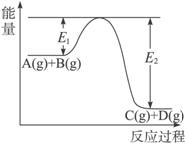
(1)该反应是_____________(填“吸热”“放热”)反应。
(2)当反应达到平衡时,升高温度,A的转化率_____________ (填“增大”“减小”或“不变”),
原因是_________________________________________________________________。
(3)反应体系中加入催化剂对反应热是否有影响并说明原因_________________________
___________________________________________。
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:?E1_____________,E2_____________ (填“增大”“减小”或“不变”)。
16.(6分)由金红石(TiO2)制取单质Ti,涉及的步骤为:
已知:①C(s)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1
②2CO(g)+O2(g) ====2CO2(g) ΔH=-566 kJ·mol-1
③TiO2(s)+2Cl2(g) ====TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
则(1)TiO2(s)+2Cl2(g)+2C(s) ====TiCl4(s)+2CO(g)的ΔH=____________________。
(2)碳在氧气中不完全燃烧生成CO的热化学方程式为_______________________________。
15.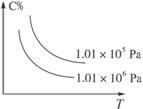 在一定条件下,对于反应mA(g)+nB(g)
在一定条件下,对于反应mA(g)+nB(g)  cC(g)+dD(g),C物质的体积分数(C%)与温度、压强的关系如图所示,下列判断正确的是( )
cC(g)+dD(g),C物质的体积分数(C%)与温度、压强的关系如图所示,下列判断正确的是( )
A.ΔH<0 m+n>c+d B.ΔH<0 m+n<c+d
C.ΔH>0 m+n>c+d D.ΔH>0 m+n<c+d
14. 工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)====Si(s)+4HCl(g) ΔH= +Q kJ·mol-1 (Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液恰好反应
13. 在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)
 CO2(g)+H2(g)
ΔH<0,下列对图像的分析中不正确的是( )
CO2(g)+H2(g)
ΔH<0,下列对图像的分析中不正确的是( )
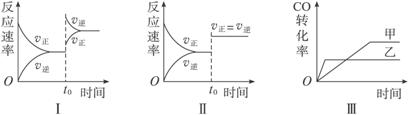
A.图Ⅰ研究的是t0时升高温度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
12. 在容积为2 L的密闭容器中,有反应:mA(g)+nB(g) pC(g)+qD(g),
pC(g)+qD(g),
经过5分钟达到平衡,此时,各物质的变化为:A减少了a mol·L-1, B的平均反应速率vB=a/15 mol·(L·min)-1,C增加了2a/3 mol·L-1,这时,若增加系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
A.3∶1∶2∶2 B.1∶3∶2∶2 C.1∶3∶2∶1 D.1∶1∶1∶1
11. 两个极易导热的密闭容器A和B(保持恒温),容器A容积恒定,容器B容积可变,在温度、压强和起始体积相同的条件下往A和B中分别充入等物质的量的NO2,发生反应2NO2 N2O4
ΔH<0,以下说法正确的是( )
N2O4
ΔH<0,以下说法正确的是( )
A.反应起始时,两容器中的反应速率关系是v(A)<v(B)
B.反应过程中,两容器内的反应速率关系为v(A)<v(B)
C.两容器内的反应达到平衡所需时间一定相同
D.反应达到平衡时,两容器内的压强关系是p(A)>p(B)
10. 已知:C(s)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1; CO(g)+1/2O2(g) ====CO2(g)
ΔH=-283 kJ·mol-1;则C(s)与O2(g)反应生成1 mol CO(g)的反应热为( )
A.ΔH=-676.5 kJ·mol-1 B.ΔH=+676.5 kJ·mol-1
C.ΔH=-110.5 kJ·mol-1 D.ΔH=+110.5 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com