
5.把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,此时若
滴入BaCl2溶液,则会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
A .SO2 B.Fe2+ C.Fe3+ D.NO3-
4.工业上从含硒废料中提取硒的方法是用H2SO4和NaNO3处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸即转化为亚硒酸(2HCl+H2SeO4=H2SeO3+Cl2↑+H2O),再通入SO2于亚硒酸的溶液中,单质硒析出。据此,确定下列叙述中正确的是( )
A.H2SeO4氧化性弱于Cl2 B.析出1mol Se需1mol SO2参加反应
C.H2SeO3 氧化性强于H2SO3 D.上述硒酸转化为亚硒酸的反应中还原产物是Cl2
3.实验室里可按图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是

A.HCl
B.Cl2
C.CO
D.NH3
2.19.2毫克铜跟适量的浓硝酸反应,铜全部作用后共收集到气体8.96毫升(标准状况),反应消耗的HNO3的物质的量可能是( )×10-3摩尔.(不考虑NO2与N2O4之间的转化)
A.0.8 B.0.9 C.1.0 D.1.2
1.镁铁混合物4.9g,溶解在过量某浓度的稀硝酸中,完全反应得到标况下气体2.24L(假设气体全为NO),则向反应后的溶液中加入足量的烧碱,则可生成沉淀的量是
A、6g B、8g C、10g D、12g
28、(14分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置A中的烧瓶内固体不可以选用 (选填序号)。
A.生石灰 B.碱石灰 C.五氧化二磷 D.烧碱
(2)B装置的作用 ;
E装置的作用 ;
(3)通入C装置的两根导管左边较长、右边较短,目的是 。
(4)装置F中发生反应的化学方程式是 。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式: 。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
。
27、(11分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO(mol) |
0.020 |
0.
01 |
0.008 |
0.007 |
0.007 |
0.007 |
 (1)写出该反应的平衡常数表达式:K=
。
(1)写出该反应的平衡常数表达式:K=
。
已知: >
> ,则该反应是 热反应。
,则该反应是 热反应。
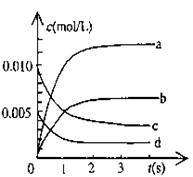
(2)右图中表示NO2的变化的曲线是 。
用O2表示从0-2s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
26、(7分)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,被称为21世纪的明星电池,其构造 如图所示:两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
(1)a是 极(填“正”或“负”),其电极反应式为 ,
b极的电极反应式 。
(2)某些碳氢化合物也可作为燃料电池的燃料,如天然气(甲烷)等。若将上图中H2换成CH4时,电池内总的反应方程式为 :CH4+2O2+2OH-=CO32-+3H2O。请写出a极的电极反应式 。
25、(8分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为______________极
 (2)滤纸B上发生的总化学方程式为:
(2)滤纸B上发生的总化学方程式为:
________________________________
 (3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为: ,电极f上发生的反应为:_____________________,槽中盛放的镀液可以是____________溶液。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为: ,电极f上发生的反应为:_____________________,槽中盛放的镀液可以是____________溶液。
24、(12分) 已知某溶液中只存在OH一、H+、NH4+、Cl一四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①(Cl一)>c(NH4+)> c(H+)> c(OH-) ②c(Cl一) >c(NH4+)> c(OH-)> c(H+)
③c(NH4+)>c(Cl一)> c(OH-)> c(H+) ④ c(Cl一) >c(H+)> c(NH4+)> c(OH-)
填写下列空白: (1)由若溶液中只溶解了一种溶质,则该溶质是__________,上述四种离子浓度的大小顺序为_______________(填序号)
(2)若上述关系中③是正确的,则溶液中的溶质为____________________;
若上述关系中④是正确的,则溶液中的溶质为________________________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________c(NH3·H2O)(填“>”、“<”或“=” 下同),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)____________ c(OH-)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com