
1.化学反应的可逆性
在同一条件下,既能向正方向又能向逆方向进行的反应称为可逆反应。
例如: N2O4 (无色) = 2NO2(红棕色)
注意:①大多数反应都具有可逆性。只是有些反应在指定的条件下,逆反应进行的程度很小。例如:
 Ag+ (aq) + Cl- (aq) AgCl(s,白色)
Ag+ (aq) + Cl- (aq) AgCl(s,白色)
②有些反应在正反应发生时,逆反应发生条件不具备,如氯酸钾在二氧化锰催化下生成氯化钾和氧气的反应,
|
2KClO3 ==== 2KCl + 3O2
其逆反应几乎不可能进行。习惯上常称之为不可逆反应。
6.2.1可逆反应与化学平衡
6.2 化 学 平 衡
6.1.4 气体的扩散-格拉罕姆(Graham)扩散定律
一种气体可以自发地同另一种气体混合,并且可以互相渗透,这种现象叫做扩散。
不同气体的扩散速度不同。在相同的温度和压力下,较重的气体扩散速度较慢,较轻的气体扩散速度较快。
1831年,英国物理学家格拉罕姆(Graham Thoms)根据实验得出如下结论:在同温同压下,气体的扩散速度与气体密度的平方根成反比。这就是格拉罕姆定律。
 =
=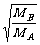
因此,格拉罕姆定律也可以叙述为:在同温同压下,气体的扩散速度与其相对分子质量的平方根成反比。
[例6-5] 已知氯气的相对分子质量为71,且臭氧与氯气的扩散速度的比值为1.193。试求臭氧的分子式。
解:已知,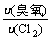 =
= = 1.193
= 1.193
所以
,M臭氧=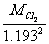 =
=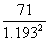 = 49.9
= 49.9
因为,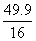 ≈3,则臭氧的分子式为O3。
≈3,则臭氧的分子式为O3。
答:臭氧的分子式为O3。
[例6-6]50 mL 氧气通过多孔性隔膜扩散需20 s,20 mL另一种气体通过该膜扩散需9.2 s,求这种气体的相对分子质量。
解:单位时间内气体扩散的体积和扩散的速度成正比,故
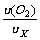 =
=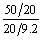 =
= =
=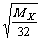
MX= 42
答:这种气体的相对分子质量为42。
5. 分体积定律:混合气体总体积等于各组分气体分体积之和。
p总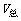 =n总RT=(n1+n2+n3+…+ni)RT
=n总RT=(n1+n2+n3+…+ni)RT
= V1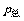 + V2
+ V2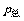 + V3
+ V3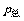 +…+ Vi
+…+ Vi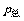
=(V1+V2+V3+…+Vi)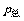
即 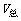 =ΣVi
=ΣVi
Vi=
χi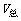
[例6-2] 由NH4NO2分解制氮气,在296K及9.56×105Pa压力下,用排水集气法收集到0.0575 L氮气,计算:
(1)氮气的分压;
(2)干燥后氮气的体积(在296K,压强为9.56×105Pa下)
(已知水在296K时的饱和蒸气压为2.81×103Pa)
解:(1)p(N2)=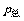 -p(H2O)
-p(H2O)
= 9.56×105-2.81×103
=9.53×105(Pa)
(2)经干燥后的氮气,其压力与混合气体总压力(外压)相同,因此具有分体积。
因为  p(N2)
p(N2)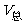 =
=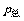 V(N2)
V(N2)
所以 V(N2)=  =
= =0.0573L
=0.0573L
4. 分压定律:1801年道尔顿(Dalton)指出:混合气体的总压等于各组分气体分压之和。分压是指某种气体i单独占有混合气体总体积(V总)时的压强(p i)
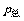 V总= n总RT=(n1+n2+n3+…+ni)RT
V总= n总RT=(n1+n2+n3+…+ni)RT
=p1V总+ p2V总+ p3V总+…+ piV总
=(p1+ p2+ p3+…+ pi)V总
即 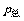 =Σ
=Σ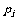
pi= χi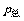
3. 分压分数、体积分数及物质的量分数(χi)之间的关系。
一定温度下,对一混合气体,其组分i的物质的量相同,则有:
*piV
= p总Vi = niRT 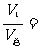
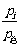
*混合气体: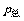 V总 =
V总 =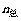 RT
RT 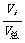 =
= 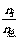 = χi
= χi
所以: 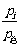 =
= 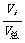 =
= 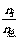 = χi
= χi
2.
分体积(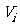 ):相同温度(T)下,组分气体i具有和混合气体相同的压强(
):相同温度(T)下,组分气体i具有和混合气体相同的压强( )时,其具有的体积(Vi)称为该组分气体的分体积。描述该组分i的理想气体状态方程为:
)时,其具有的体积(Vi)称为该组分气体的分体积。描述该组分i的理想气体状态方程为:
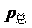 Vi =niRT
Vi =niRT
1. 分压(pi):一定温度(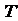 )下,当混合气体中组分i(物质的量为ni)单独占据混合气体总体积(
)下,当混合气体中组分i(物质的量为ni)单独占据混合气体总体积( )时的压强(
)时的压强(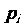 ),称为该组分气体的分压。
),称为该组分气体的分压。
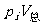 =niRT
=niRT
6.1.3 混合气体分压定律
前面讨论的是单组分理想气体的性质。对互不作用且混合均匀的气体,气体的总压与各组分气体的分压、气体的总体积与各组分气体的分体积之间有哪些关系?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com