
7. 平衡转化率
平衡转化率是指平衡时已转化了的某反应物的量与转化前该反应物的量之比。
自学一会儿。例题
6. 平衡常数的意义
⑴对于一个指定的反应,平衡常数Kp, Kc, Kθ仅是温度的函数。K值的大小可判断反应进行的程度,估计反应的可能性。如:
N2 + O2 = 2NO Kc=1*10-30(298K) 基本不能进行,但在高温(雷电)条件下平衡常数增大。
2Cl(g)=Cl2(g) Kc=1*1038(298K) 反应进行非常彻底
2SO2 + O2 = 2SO3 Kc=3.6×1024(298K) (速度极慢)V2O5可做催化剂
对平衡常数很大的反应,我们可以用加快速度的方法来为所用;对平衡常数极小的反应,应终止此条件下的实验而设法改变条件使反应在新的条件下进行的比较完全。一般常数在10-7-107之间属于典型的可逆反应。
⑵平衡常数表达式表明一定温度下体系达成平衡的条件。一个体系达到平衡状态的标志就是①各物质的浓度将不随时间改变,②其产物浓度系数次方的乘积与反应物浓度系数次方的乘积之比是一个常数。即
aA + bB = dD + eE
当 [D]d[E]e/[A]a[B]b = Kc时,体系处于平衡状态。不符合此两项条件就不是平衡状态。
(3) 用Jc和Kc 的相对大小,判断反应是否平衡及反应进行的方向
 p A + q B d D + e E
p A + q B d D + e E
定义任意状态下:
 称为浓度商
称为浓度商
 称为分压商
称为分压商
 称为活度商
称为活度商
可以利用KC和JC(KP和JP,  和J )的关系来判断反应自发进行的方向:
和J )的关系来判断反应自发进行的方向:
Jc>Kc Jp>Kp J > 逆向反应自发进行
逆向反应自发进行
Jc<Kc Jp<Kp J < 正向反应自发进行
正向反应自发进行
Jc=Kc Jp=Kp J = 体系处于平衡状态
体系处于平衡状态
如果Jc<Kc,则反应只有正向进行,产物浓度的计量数次幂的乘积与反应物浓度的计量数次幂的乘积之比才有可能等于平衡常数,才有可能达到平衡状态。
如果Jc>Kc,则反应只有逆向进行,上述比值才有可能等于平衡常数。
当Jc=Kc时,反应达到平衡状态。
(4)平衡常数数值的大小,不能预示反应达到平衡所需要的时间。有的反应虽然平衡常数数值极大,但因反应速度太慢,该反应也没有现实意义。如反应:2SO2(g)+O2(g)=2SO3(g),298时,KP=3.6×1024,虽然平衡常数很大,但由于速度太慢,常温时,几乎不发生反应。
5. 多重平衡规则
在实际化学反应过程中,体系中往往几个反应同时发生,某种物质常同时参加几个反应。当这样的反应体系达到平衡时,几个反应同时建立平衡,这种现象称为多重平衡。
在多重平衡体系中,同时参与几种平衡的物质的浓度或分压必然同时满足几个平衡。例如,在一高温体系中有FeO(s),CO(g),C(s)和CO2(g)等四种物质,它们之间存在下列反应:
 (1)CO2(g)+
C(s)
2CO(g)
(1)CO2(g)+
C(s)
2CO(g)
 (2)FeO(s)
+ CO(g)
CO2(g) + Fe(s)
(2)FeO(s)
+ CO(g)
CO2(g) + Fe(s)
 (3)FeO(s)
+ C(s)
CO(g) + Fe(s)
(3)FeO(s)
+ C(s)
CO(g) + Fe(s)
当该体系达到平衡状态时,相应的平衡关系式为:
 ,
, ,
, 
由于体系中同一种气态物质(如CO)的分压只能是一个值,它必须同时满足三个平衡,经换算可知:
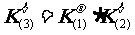
①反应3 =反应2 + 反应1, 则K3=K2·K1
②反应3 =反应2 – 反应1, 则K3=K2/K1,
③反应2 = 2×(反应1), 则K2=(K1)2 依次类推(如开方、乘方)。
④反应2 = -反应1, 则K2 = 1/K1
4. 书写平衡常数关系式的规则
①对于参与反应(相平衡中)的纯固体、纯液体其浓度、活度视为常数(1)
CaCO3(s) = CaO(s) + CO2(g)
Kc= [CO2] Kp=p(CO2)  =α(CO2)
=α(CO2)
CO2(g) + H2(g) = CO(g) + H2O(l)
②稀溶液中的溶剂,由于它们的浓度在反应过程中可以认为是不变的,所以,不以其浓度项的形式出现在平衡常数表达式中。
2CrO42- + 2H+ = Cr2O72- + H2O
但非水溶液中的反应,如有水参加则水必须计入其内。如酯化反应:
 CH3COOH + C2H5OH CH3COOC2H5
+ H2O
CH3COOH + C2H5OH CH3COOC2H5
+ H2O
中的少量水,H2O的浓度要出现在平衡常数表达式中。
稀溶液中的均相反应及反应方程式中不出现气体的其它反应,没有压力平衡常数。
③固体-气体-溶液中的溶质(离子或分子)间的平衡,如:
 Zn(s)+ 2H+(aq) Zn2+(aq)
+ H2(g)
Zn(s)+ 2H+(aq) Zn2+(aq)
+ H2(g)
其经验平衡常数K的表达式为:

标准平衡常数的表达式中各物质都代为活度。
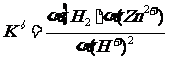
3. 平衡常数与反应方程式
同一化学反应,可以用不同的反应方程式来表示,对应各自的平衡常数表达式及相应的平衡常数和量纲,它们呈某种方次的关系。
以反应2NO2(g) =N2O4(g)为例,373K时
2NO2(g)=N2O4(g) (1) Kc(1)= =2.78
=2.78
NO2(g) =  N2O4(g)
(2) Kc(2)=
N2O4(g)
(2) Kc(2)= =(Kc(1))
=(Kc(1))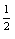 =1.67
=1.67
Kc(1)=(Kc(2))2
当然 N2O4(g)
=2NO2(g) (3) Kc(3)= =(Kc(1))-1
=0.36
=(Kc(1))-1
=0.36
Kc(1) = 1/ Kc(3)
对应Kp 、 都有类似的关系
都有类似的关系
2.化学反应等温式和标准平衡常数
由热力学可知,物质的摩尔自由能统一定义为:

对于一个任意的化学反应
 pA + q B d D + eE
pA + q B d D + eE
若反应体系中各种物质保持任一活度ai的情况下其反应进度ξ为1摩尔,其自由能变化为:
ΔrGm= e Gm(E) + d Gm(D)- pGm(A)-qGm(B)
= e[GmӨ(E)+RTlnaE]+d[GmӨ(D)+RTlnaD]
-p[GmӨ(A)+ RTlnaA]-q[GmӨ(B)+ RTlnaB]
=eGmӨ(E)+dGmP(D)-pGmP(A)-qGmP(B)
+RT(lnaeE+lnadD- lnapA- lnaqB)
= ΔrGmӨ+RTln
即: ΔrGm=ΔrGmӨ+RTln
令J代表反应在任意状态下的比值 (称为活度商),则:
(称为活度商),则:
ΔrGm= + RT lnJ
+ RT lnJ
此式称为(Vant′huff)等温方程。反应:
 p A + q B d D + e E
p A + q B d D + e E
达到平衡时, ΔrG = 0, 即:
 + RTln
+ RTln =0
=0
对于一个确定的反应方程式,一定温度下,ΔrGmӨ一定。所以,平衡时的活度商(J )为一常数,记作
)为一常数,记作 ,称为反应的标准平衡常数。
,称为反应的标准平衡常数。
 = -RT ln
= -RT ln
式中: 
 的单位为J·mol-1时,R取8.314J·mol-1·K-1。可以看出
的单位为J·mol-1时,R取8.314J·mol-1·K-1。可以看出 仅是温度的函数。
仅是温度的函数。
活度(ai):①气态物质i服从理想气体定律,其活度是ai ,则 ;②溶液中溶质的离子或分子,它们的活度ai为:
;②溶液中溶质的离子或分子,它们的活度ai为: (γi为活度系数,
(γi为活度系数,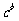 为标准浓度,取1mol•L-1);③对纯固体、纯液体及溶液中的溶剂,ai看作1。
为标准浓度,取1mol•L-1);③对纯固体、纯液体及溶液中的溶剂,ai看作1。 的量纲为1。
的量纲为1。
(1)对于溶液中进行的反应:
 p A(aq) + q B(aq) d D(aq) + e E(aq)
p A(aq) + q B(aq) d D(aq) + e E(aq)
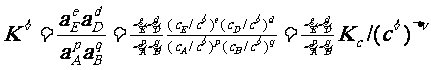
稀溶液中进行的反应,γA≈γB≈γE≈γD≈1,
看作ai与ci相等, 和Kc在数值上相等,即有:
和Kc在数值上相等,即有:
 = -RTlnKc
= -RTlnKc
(2)有气体参加的反应,将 代入
代入 表达式中进行计算。
表达式中进行计算。
 p A(g) + q B(g) d D(g) + e E(g)
p A(g) + q B(g) d D(g) + e E(g)

 = -RTln
= -RTln
经验平衡常数(无论是Kp 、Kc)与标准平衡常数 ,它们的数值及量纲一般都不相等。
,它们的数值及量纲一般都不相等。
1. 化学平衡定律和经验平衡常数
经过对多种类型的可逆反应的研究,人们总结出了化学平衡定律: 一定温度下,可逆反应达平衡时,各生成物的浓度(或分压)以其计量数为乘幂的乘积与各反应物的浓度(或分压)以其计量数为乘幂的乘积之比是一个常数,称为平衡常数。
即,对于一个普通的气相可逆反应:
 a A(g)
+ b B(g) d D(g) +e E(g)
a A(g)
+ b B(g) d D(g) +e E(g)
一定温度下达平衡时, 存在如下关系:
 = Kc
= Kc
 = Kp
= Kp
因为混合气体中,气态物质的分压为 ,所以:
,所以:

即,
分压的单位取kPa, 浓度的单位取mol·L-1时,R的数值为8.314 kPa·L·mol-1·K-1。所以在一定温度下,KC是常数,KP也一定是常数。KC和KP常称为实验平衡常数或经验平衡常数。经验平衡常数一般是有量纲的量。
6.2.2 化学平衡常数
3.平衡转化率
平衡状态下,平衡组成不再随时间发生变化,因此平衡状态是封闭体系中可逆反应自发进行的最大限度。平衡时反应物转化成产物的转化率(α):
某反应物的转化率(α)= %
%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com