
1.下列各组物质气化或熔化时,所克服的微粒间的作用(力),属同种类型的是
A.碘的升华和NH4Cl的“升华”
B.二氧化硅和生石灰的熔化
C.氯化钠和铁的熔化
D.苯和己烷的蒸发
3.判断下列有关化学基本概念的依据正确的是
A.氧化还原反应:元素化合价是否变化
B.共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小
D.金属晶体:晶体是否能够导电
[课后巩固]
2.下列能够用“键能”解释的有:
A.N2参加反应时,多数需要“高温、高压、催化剂”等苛刻的条件
B.稀有气体一般与其它物质很难发生化学反应
C.常温常压下,氯气呈气态,溴呈液态
D.硝酸见光容易分解,必须保存在棕色细口玻璃瓶中
1.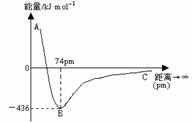 如果两个电子自旋方向相反的氢原子互相靠近时,两个原子轨道则发生重叠,当核间距为74pm时,两个原子轨道发生最大程度的重叠,此时体系的能量最低。右图表示两个气态基态氢原子相互接近形成氢气分子时,体系能量随两个原子的核间距离变化的曲线图,下列关于氢原子形成氢分子说法不正确的有
如果两个电子自旋方向相反的氢原子互相靠近时,两个原子轨道则发生重叠,当核间距为74pm时,两个原子轨道发生最大程度的重叠,此时体系的能量最低。右图表示两个气态基态氢原子相互接近形成氢气分子时,体系能量随两个原子的核间距离变化的曲线图,下列关于氢原子形成氢分子说法不正确的有
A.氢分子比氢原子稳定
B.氢原子的半径约为37pm
C.形成一个H-H键吸收436kJ能量
D.当核间距接近74pm时,形成了氢分子中s-s σ键
1.由非金属元素构成的晶体不一定为分子晶体。如NH4Cl。2.具有导电性的晶体不一定是离子晶体。如Si、石墨。3.离子晶体不一定只含离子键。如NaOH、FeS2。4.由氢化物构成的晶体不一定是分子晶体。如NaH。5.金属与非金属元素构成的晶体不一定是离子晶体。如AlCl3为分子晶体。6.原子晶体不一定为绝缘体:如Si。7.溶于水能导电的晶体不一定是离子晶体:如HCl。8.离子晶体的熔点不一定低于原子晶体。如MgO的熔点为3073℃,而SiO2只有1723℃。9.金属晶体的熔点不一定低于原子晶体,如W的熔点达3410℃。10.金属晶体的熔点不一定高于分子晶体,如Hg常温下呈液态,而硫、白磷常温下呈固态。11.金属晶体的硬度不一定小于原子晶体,如Cr的硬度为9,仅次于金刚石。12.金属晶体的硬度不一定大于分子晶体,如Na的硬度只有0.4,可用小刀切割。13.晶体中有阳离子不一定有阴离子,如构成金属晶体的微粒是由阳离子和自由电子构成。
[典型例析]
例1:(1)某研究性学习小组为了探究SbCl3、SbCl5、SnCl4三种化合物的成键特点,做了如下实验,其中正确的是________________。
A.观察常温下的状态。SbCl5是苍黄色液体,SnCl4为无色液体。结论:SbCl5和SnCl4都是离子化合物
B.测定SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8 ℃、-33℃。结论:SbCl3、SbCl5、SnCl4都不是离子化合物
C.将SbCl3、SbCl5、SnCl4溶解于水中,滴入HNO3酸化的AgNO3溶液,产生白色沉淀。结论:SbCl3、SbCl5、SnCl4都是离子化合物
D.测定SbCl3、SbCl5、SnCl4的水溶液,发现它们都可以导电。结论:SbCl3、SbCl5、SnCl4都是离子化合物
(2)针对上述正确的实验结论,可判断SbCl3和SnCl4中Sb和Sn的杂化类型分别是________、_______。
(3)实验测得在极性溶剂中SbCl5的溶解度比SbCl3小很多,其主要原因是_______________________。
(4)实验测得同周期的Sb原子比Sn原子的第一电离能大很多,其主要原因______________________。
变式训练:随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分CH4)为原料经合成气(主要成分CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请问答下列问题:
(1)Fe(CO)5中铁的化合价为0,写出铁原子的基态电子排布式
(2)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式),CO分子的结构式可表示成 。
(3)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断Fe(CO)5晶体为
。
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 ,CH3OH的熔、沸点比CH4的熔、沸点比高,其主要原因是 。
例2:有A、B、C、D、E、F、G七种元素,除E为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区,A、E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素的第一电离能列同周期主族元素第三高;F的基态原子核外成对电子数是成单电子数的3倍;G的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。回答下列问题:
(1)写出下列元素的符号:D ,G ;
(2)D的前一元素第一电离能高于D的原因: _ ;
(3)由A、B、C形成的ABC分子中,含有 个σ键,
____ 个π键;
(4)由D、E、F、G形成的盐E2DF4、GDF4的共熔体在冷却时首先析出的物质是 (写化学式),原因是 ____________________________________________ ;
变式训练:
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Ge的原子核外电子排布式为___________________。
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是________________。
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式_______;
②SiO2晶体的空间构型及硅氧之间的成键方式_______;
③已知SnO2是离子晶体,写出其主要物理性质___________(写出2条即可)。
(4)CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为_________。
(5)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060 cm-1,CO分子中碳氧键的伸缩振动频率为2143 cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度________(填字母)
A.强 B.弱 C.相等 D.无法判断
[当堂反馈]
2.金属晶体的性质
(1)电子能在电场中作定向移动,故金属都具有导电性,温度升高,导电性减弱。
(2)金属键没有方向性,当金属受到外力作用时,各层间发生相对滑动,但金属键仍然存在,原子不改变原有的排列方式,故金属具有延展性。
(3)金属局部受热时,电子运动加快,与金属原子频繁碰撞并发生能量交换,使距受热部位较远的部分温度升高,故金属具有导热性。
(4)不同金属晶体中金属键强度相差很大,金属的熔点、硬度相差也很大。一般情况下,金属原子的价电子数越多,原子或离子半径越小,金属键越强,熔沸点越高。
(5)在金属中掺入其他金属或非金属形成合金,能改变金属的熔点、延展性、硬度等性质,使金属具有更为广泛的用途。一般合金的熔点比成分金属的熔点低,硬度比成分金属大。
1.金属键的本质:金属阳离子和自由电子之间强烈的相互作用。
2.晶格能:气态离子形成1mol离子晶体时放出的能量叫晶格能,阴阳离子的半径越小、电荷数越高,离子键越强,晶格能越大,晶体越容易形成,且晶体越稳定,硬度越大,熔点越高。
1.离子键的本质:阴、阳离子间的静电作用,离子键无方向性和饱和性。
3.共价键的键参数
(1)键能:原子失去电子要吸收能量,吸引电子要放出能量;断裂化学键要消耗能量,形成化学键要放出能量。键能是指:气态、基态原子形成1mol共价键释放的最低能量。键能越大,说明破坏(或形成)化学键时吸收(或放出)的能量越多,化学键越牢固。
(2)键长:指成键原子的核间距离,它与共价键稳定性的关系是键长越小,共价键越稳定,我们通常通过比较两原子的共价半径来比较共价单键键长大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:键角是分子内两键间的夹角,它是描述分子立体结构的重要参数,多原子分子内的键角是一定的,这表明共价键具有方向性。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com