
3.用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是
A.NH4+为正四面体形 B.CS2为直线形
C.HCN为折线形(V形) D.PCl3为三角锥形
2.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.NH3中氮原子为sp2杂化,而CH4中碳原子是sp3杂化。
B.NH3中N原子形成三个杂化轨道,CH4中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.NH3分子中有三个σ键,而甲烷分子中有四个σ键。
1.六氟化硫分子呈正八面体(如下图所示),在高电压
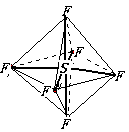 下仍有良好的绝缘性,在电器工业方面有着广泛的用
下仍有良好的绝缘性,在电器工业方面有着广泛的用
途,但逸散到空气中会引起强温室效应,下列有关六氟化硫的推测正确的是:
A.六氟化硫易燃烧生成二氧化硫
B.六氟化硫中各原子均达到8电子稳定结构
C.S-F键是 σ键,且键长、
键能都相等
D.六氟化硫分子中只含极性键
5.水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为 ;
(2)写出与H2O分子互为等电子体的微粒 。(写一个即可)
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是 。
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
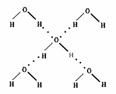 (4)在冰晶体中,每个水分子与相邻的4个水分子形成氢
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢
键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是 __________kJ/mol(此时的气态水不含氢键)。
(5)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配位数是4的配合离子。请写出生成此配合离子的离子方程式:
。
[课后巩固]
4.图表法、图象法是常用的科学研究方法。
I.短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第 族。

II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是____ ,理由是: 。
3.下列物质性质的变化规律,与共价键键能大小有关的是
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
2.已知次氯酸分子的结构式为H-O-Cl,下列有关说法正确的是
A.O原子发生sp杂化
B.O原子与H、Cl都形成σ键
C.该分子为直线型分子
D.该分子的路易斯结构式是:
1.某物质化学式为NH5,对该物质中所含化学键的分析合理的是
A.N原子发生sp3d杂化形成5个σ键
B.含4个共价键和1个配位键
C.含3个共价键和2个配位键
D.含有共价键、配位键和离子键
4.无机含氧酸分子的酸性:(1)一般地,无机含氧酸分子中能够电离成H+的H原子都是与O原子相连的,即羟基氢,不与O原子相连的H原子一般不能电离。(2)大多数无机含氧酸的通式可以写成(HO)mROn的形式,非羟基氧的个数n越大,R的正电性越高,羟基O的电子云向R偏移得越多,越容易在水分子的作用下电离出H+,酸性越强。① 同一元素的含氧酸,该元素的化合价越高,酸性越强。③ 成酸元素不同时,非羟基氧数n越大,酸性越强;n相同,酸性相近。
[典型例析]
例1:下列物质变化的现象,不可以通过分子间作用力解释的是
A.HF、H2O的沸点比HCl、H2S的沸点高很多
B.正戊烷的沸点比新戊烷的沸点高
C.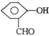 的沸点比
的沸点比 的沸点低
的沸点低
D.Na2O的熔点比MgO的熔点低
变式训练:2005年,苏丹红造成了全球性的食品安全事件,被称为自英国发生疯牛病以来最大的食品工业危机事件。苏丹红常见有I、Ⅱ、Ⅲ、Ⅳ4种类型,国际癌症研究机构(IAPC)将其归类为三级致癌物。由于苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆晶等的染色剂,严重危害人们健康。因此,加强苏丹红的监管对维护人们健康和社会稳定十分重要。苏丹红I号的分子结构如图1所示。

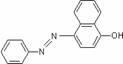
图1 苏丹红I号的分子结构 图2 修饰后的分子结构
(1)苏丹红1分子中的氮原子杂化类型是 ,其分子中所有原于是否有可能在同一平面 _______(填“是”或“否”),画出它的两个顺反异构体的结构简式: 、 。
(2)苏丹红I在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成图2所示结构,则其溶解度会 (填“增大”或“减小”),熔点 (填“升高”或“降低”),原因是 。
例2:由氧化物经氯化作用过生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如:
 Na2O+Cl2=2NaCl+O2,
Na2O+Cl2=2NaCl+O2,
CaO+Cl2=CaCl2+O2,
SiO2+2CCl4=SiCl4+2COCl2,
Cr2O3+3CCl4=2CrCl3+3COCl2,
请回答下列问题:
(1)Cr2O3、CrCl3中Cr均为+3价,写出Cr3+的基态电子排布式_______________ ;
(2)CCl4分子的价层电子对互斥模型和立体结构___________(填“相同”、“不相同”),理由是_________;
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是_________,其中碳氧原子之间共价键是___________(填序号):
a.2个σ键 b.2个π键 c.1个σ键、1个π键
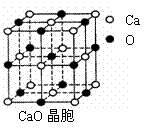
(4)CaO晶胞如右上图所示,CaO晶体中Ca2+的配位数为_________。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3 401kJ/mol、NaCl-786kJ/mol。导致两者晶格能差异的主要原因是______
_______________________________________________。
变式训练:
A物质常温下为固体,且有多种同素异形体。反应:①A(g)+CH4(g) B+D;
B+D;
②D+H2SO4(浓)→E+A+H2O;③E+D→A+H2O;④D+NaOH→F+H2O;⑤B+H2O→CO2+D;⑥B+F→G。上述六个未经配平的反应方程式中,D和E为气体,它们的分子形状都为V字形,但D中的杂化轨道为sp3,而E中为sp2,E和臭氧是等电子体;G为钠盐,其阴离子经过光衍射出构型为平面三角形。A是________,B是________,D是_________,E是________,F是________,G是_________,G应命名为____________。
[当堂反馈]
3.物质的溶解性及其影响因素:(1)分子极性:非极性分子构成的物质易溶于非极性溶剂、难溶于极性溶剂;极性分子构成的物质易溶于极性溶剂、难溶于非极性溶剂。如苯易溶于植物油而难溶于水;HCl易溶于水而难溶于苯。(2)分子结构:含有相同官能团且该官能团在分子中所占比重较大的物质能够相互溶解。例如,乙醇与水能互溶,戊醇与水不能互溶、与己烷能互溶。(3)氢键:溶质与溶剂分子之间若能形成分子间氢键,则会增大溶解度。(4)反应性:溶质若能与溶剂能发生反应,则会增大溶解度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com