
1.能够说明氨水是弱碱的事实是 ( )
A.氨水具有挥发性
B.1mol·L-1氨水溶液的pH=10
C. 1mol·L-1NH4Cl溶液的pH=5
D.氨水与AlCl3溶液反应生成Al(OH)3
2.物质的的浓度、体积都相同的NaF和NaCN溶液中,离子总数的关系正确的是(已知HF比HCN易电离) ( B)
A.NaF=NaCN B. NaF>NaCN C. NaF<NaCN D.无法确定
检测提高
1.在Na2S溶液中存在着多种离子和分子,下列关系正确的是 ( )
A.(OH-)=(HS-)+(H+)+(H2S)
B.(OH-)=(HS-)+(H+)+2(H2S) C.(OH-)=(HS-)+2(H+]+(H2S)
D.(Na+)>(S2-)>(OH-)>(HS-)
4.以下几种情况不需要考虑盐的水解
⑴强碱弱酸盐与酸或碱反应时不考虑盐的水解: 如碳酸钠与盐酸反应。
⑵强酸弱碱盐与碱或酸反应时不考虑盐的水解: 如氯化铝与氨水反应。
⑶两种盐溶液混合如复分解反应生成难溶物,即使有“两弱” 也不考虑盐的水解:如硫 化钠与硫酸铜溶液反应。
⑷具有氧化性的离子与还原性的离子的盐溶液混合时不考虑盐的水解:如三氯化铁溶液与硫化钠溶混合。
纠错训练
3. 对电解质溶液中离子之间的几种守恒关系(即物料守恒、电荷守恒、质子守恒)弄不清楚,在分析问题时造成失误。
2. 在溶液中的离子浓度比较时,对溶液中同时存在电离和水解时,弄不清是电离占主导,还是水解占主导,从而造成解题失误。
1. 在溶液中离子个数比较时,一是忽略强弱电解质,二是忽略离子的水解,从而造成对问题的错误分析。
15.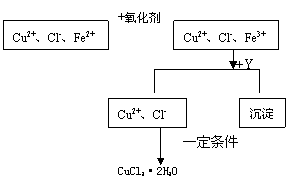
 CuCl2溶液中含少量杂质FeCl2为制备晶体CuCl2·2H2O,拟定实验步骤如图所示
CuCl2溶液中含少量杂质FeCl2为制备晶体CuCl2·2H2O,拟定实验步骤如图所示


请回答下列问题:
(1) 最适宜的氧化剂是
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y是
(3)除去Fe3+的有关离子方程式是
(4)为了防止水解,要得到CuCl2·2H2O应控制得一定条件是 。
(本题综合考查盐的水解、氧化还原反应、离子方程式书写)
第16课时 盐类的水解(B卷)
易错现象
14.在电解质溶液中,不论存在多少离子,总有下列守恒关系:
(1)电荷守恒:电解质溶液中无论含多少种离子,但溶液总是呈电中性的。即整个溶液中________所带的负电荷总数一定等于_____所带正电荷总数。
如在Na2CO3溶液中有__________________ __
(2)原子守恒(物料守恒):电解质溶液中尽管有些离子水解、电离等原因发生改变,但某原子总数是保持不变的。
如Na2CO3中存在___________________ _.
(3)质子守恒:在多元弱酸的正盐中,由于存在酸根离子的多步水解,每步水解的过程中酸根离子每结合一个H+,溶液中必定余出一个OH-。考虑水的电离有一个等量关系。
如Na2CO3中存在___________________
(本题考查学生盐溶液中的三个守恒和应变能力)
13.盐的水解平衡会受到温度、浓度及外加酸碱等因素的影响,对于下列水解反应:Fe3++3H2O Fe(OH)3+3H+,填写改变条件后所发生的变化(水解程度和pH填“增大”“不变”“减小”)
Fe(OH)3+3H+,填写改变条件后所发生的变化(水解程度和pH填“增大”“不变”“减小”)
|
条件 |
平衡移动方向 |
Fe3+的水解程度 |
PH |
|
|
浓度 |
加FeCl3 |
|
|
|
|
加水 |
|
|
|
|
|
温度升高 |
|
|
|
|
|
加HCl |
|
|
|
|
|
加少量的NaOH |
|
|
|
|
|
加Na2CO3 |
|
|
|
(本题考了影响水解的因素)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com