
2.比较盐溶液中各离子浓度的相对大小时,当盐中含有 的离子,需考虑盐的水解。
1.判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需考虑 。
如:相同条件,相同物质的量浓度的下列八种溶液:Na2CO3、NaClO、CH3COONa、Na2SO4、NaHCO3、NaOH 、(NH4)2SO4、NaHSO4等溶液,pH值由大到小的顺序为:
NaOH>NaClO>Na2CO3>NaHCO3>CH3COONa >Na2SO4>(NH4)2SO4>NaHSO4
4.混合溶液中各离子浓度的比较,要进行综合分析,如电离因素,水解因素等。
(1)弱酸与含有相应酸根的盐混合,若溶液呈酸性,说明弱酸的电离程度 相应酸根离子的水解程度。如CH3COOH与CH3COONa溶液呈 ,说明CH3COOH的电度程度比CH3COO-的水解程度要大,此时,c(CH3COOH)<c(CH3COO-)。
(2)弱酸与含有相应酸根的盐混合,若溶液呈碱性,说明弱酸的电离程度 相应酸根离子的水解程度。
如HCN与NaCN的混合溶液中,c(CN-)<c(Na+),则说明溶液呈碱性,HCN的电度程度比CN-的水解程度要 ,则c(HCN)>c(CN-)。
(3)弱碱与含有相应弱碱阳离子的盐的混合的情况,与(1)、(2)的情况类似。
|
[特别提醒]理解透水解规律:有弱才水解,越弱越水解,谁强显谁性。 |
[例2] 在0.1 mol·L-1的 NH4Cl和0.1 mol·L-1的氨水混合溶液中,各离子浓度的大小顺序。
[答案]c(NH4+)>c(Cl-)>c(OH-)>c(H+)。在该溶液中,NH3·H2O的电离与NH4+的水解互相抑制,NH3·H2O电离程度大于NH4+的水解程度时,溶液呈碱性:c(OH-)>c(H+),同时c(NH4+)>c(Cl-)。
[规律总结] 要掌握盐类水解的内容这部分知识,一般来说要注意几个方面:1、盐类水解是一个可逆过程;2、盐类水解程度一般都不大;3、要利用好守恒原则即电量守恒和物料守恒(这两个方法在比较离子浓度和相关计算方面有较多的运用)。
考点3 盐类水解的应用
3.不同溶液中同一离子浓度的比较,要看溶液中其他离子对其影响的因素。如相同物质的量浓度的下列各溶液中①NH4Cl ②CH3COONH4 ③NH4HSO4,c(NH4+)由大到小的顺序是 。
2.多元弱酸的正盐溶液根据弱酸根的分步水解分析,如Na2 S溶液中c(Na+)>c(S2-)>c(OH-)>c(HS-)
(1)水解 :盐+水 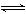 酸 + 碱,ΔH 0
酸 + 碱,ΔH 0
(2)盐类水解的程度一般比较 ,不易产生气体或沉淀,因此书写水解的离子方程式时一般不标“↓”或“↑”;但若能相互促进水解,则水解程度一般较大。
|
[特别提醒]:分析影响盐类水解的主要因素是盐本身的性质;外界因素主要有温度、浓度及外加酸碱等因素。 强碱弱酸盐:弱酸根离子与水电离出的H+结合生成弱酸或弱酸酸式酸根离子,从而使溶液中c(H+)减小,c(OH-)增大,即c(OH-)>c(H+)。如Na2CO3,NaHCO3 强酸弱碱盐:弱碱阳离子与水电离出的OH-结合生成弱碱,从而使溶液中c(H+)增大,c(OH-)减小,即c(OH-)>c(H+)。NH4Cl,AlCl3 弱碱弱酸盐:弱碱阳离子与水电离出的OH-结合生成弱碱,弱酸根离子与水电离出的H+结合生成弱酸或弱酸酸式酸根离子。CH3COONH4 |
[例1] 25℃时,相同物质的量浓度下列溶液中,水的电离程度由大到小排列顺序正确的是( ) ①KNO3 ②NaOH ③CH3COO NH4 ④NH4Cl A、①>②>③>④ B、④>③>①>② C、③>④>②>① D、③>④>①>②
[解析]①KNO3为强酸强碱盐,在水溶液中电离出的K+和NO-对水的电离平衡无影响;
②NaOH为强碱在水溶液中电离出的OH-对水的电离起抑制作用,使水的电离程度减小;
③CH3COONH4为弱酸弱碱盐,在水溶液中电离出的NH4+和CH3COO-均可以发生水解生成弱电解质NH3·H2O和CH3COOH,并能相互促进,使水解程度加大从而使水的电离程度加大。
④NH4Cl为强酸弱碱盐,在水溶液中电离出的NH4+ 可以发生水解生成弱电解质NH3·H2O,促进水的电离,但在相同浓度下其水解程度要小于CH3COONH4,该溶液中水的电离程度小于CH3COONH4中的水的电离程度。
[答案]D
[规律总结]酸、碱对水的电离起抑制作用,盐类的水解对水的电离起促进作用。
考点2溶液中粒子浓度大小的比较规律
1.多元弱酸溶液,根据 电离分析,如在H3PO4的溶液中,
(1) 了水的电离。
(2)盐溶液呈什么性,取决于形成盐的对应的酸、碱的相对强弱;如强酸弱碱盐的水溶液显 ,强碱弱酸盐的水溶液显 ,强酸强碱盐的水溶液显 ,弱酸弱碱盐的水溶液是 。(3)生成了弱电解质。
4. 有关酸、碱溶液的稀释 强酸溶液每稀释10倍,pH增大一个单位,弱酸溶液每稀释10倍,pH增大不到一个单位;强碱溶液每稀释10倍,pH减小一个单位。弱碱溶液每稀释10倍,pH减小不到一个单位。
|
[特别提醒]:混和后溶液呈酸性时,一定用c(H+)计算pH;呈碱性时,一定用c(OH-)计算pH值。 |
[例3] 求下列溶液的pH:
(1)某H2SO4溶液的浓度是0.005mol/L:①求此溶液的pH;②用水稀释到原来体积的100倍;③再继续稀释至104倍
(2)pH=3的盐酸与pH=5的硫酸等体积混合
(3)pH=10和pH=12的两种NaOH溶液等体积混合
(4)pH=12的NaOH和pH =4的HCl等体积混合
[解析](1)① c(H+)=0.005mol/L×2=0.01 mol/L ,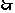 pH=-lg10-2=2
pH=-lg10-2=2
② c(H+)=0.01mol/L÷100=10-4 mol/L ,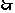 pH=-lg10-4=4
pH=-lg10-4=4
③ pH=7(强调酸稀释后不会变成碱!)
(2)c(H+)=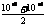 =5×10-4,
=5×10-4, 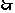 pH=-lg(5×10-4)=4-lg5=3.3
pH=-lg(5×10-4)=4-lg5=3.3
(强调10-3是10-5的100倍,所以10-5可以忽略不计)
(3)因为溶液呈碱性c(OH-)=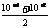 =5×10-3
=5×10-3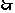 c(H+)=
c(H+)= =2×10-12
=2×10-12
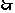 pH=-lg(2×10-12)=12-lg2=11.7
pH=-lg(2×10-12)=12-lg2=11.7
(4)NaOH中c(OH-)=10-2 mol/L,HCl中c(H+)=10-4
mol/L 二者等体积反应,碱过量,反应后溶液呈碱性。所以反应后c(OH-)=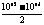 =5×10-3
=5×10-3 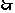 c(H+)=
c(H+)=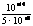 =2×10-12
=2×10-12 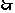 pH=-lg(2×10-12)=12-lg2=11.7
pH=-lg(2×10-12)=12-lg2=11.7
[规律总结] (1)两强酸等体积混合 混合后的pH=小的+0.3
(2)两强碱等体积混合 混合后的pH=大的-0.3
(3)当按所给反应物质的量之比计算时,酸碱不论强弱,谁大谁过剩,溶液呈谁性。
(4)酸碱等体积混合①pH = 2 某酸与pH = 12 某碱混合pH难定;②pH = 4 某酸与pH = 10 NaOH混合 pH≤7;③pH = 4 H2SO4与pH = 10 某碱混合pH≥7;④0.01mol/L pH = 2 一元酸与0.1mol/L pH = 12一元碱混合pH = 7
(5) pH 减小一个单位,c(H+)扩大为原来的10倍。 pH增大2个单位,c(H+)减为原来的1/100
(6)稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的 1/m , 强酸中c(H+)变为原来的1/m ,但弱酸中c(H+)减小 小于m倍,故稀释后弱酸酸性强于强酸。
3.强酸和强碱混和,先确定过量离子的浓度:
若H+过量 c(H+)=(c(H+)酸V酸-c(OH_)碱V碱)/(V酸+V碱)
若碱过量 c(OH-)=(c(OH-)碱V碱 -c(H+)酸V酸)/(V碱+V酸)
当酸过量时,必须以剩余的氢离子浓度来计算溶液的 PH 值;当碱过量时,必须以剩余的氢氧根离子浓度来计算溶液的POH值,再求pH值。
2.两种强碱溶液混和,先求c(OH-),再通过 求c(H+),最后求pH值.
C(OH-)=
两种强碱溶液等体积混和,且原溶液pH值相差≥2时,把稀溶液(pH值较小的)当作水来处理,混和液的pH=大pH-0.3。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com