
(1)等: (2)动:
(3)定:达到平衡时,溶液中
(4)变:当外界条件改变,溶解平衡将
例:NaCl(s) Na+(aq)+Cl-(aq)
AgCl(s)
Na+(aq)+Cl-(aq)
AgCl(s) Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
10.明矾能够用来净水的原理
|
[特别提醒]:盐类水解的应用都是从水解的本质出发的。会解三类习题:(1)比较大小型,例:比较PH值大小;比较离子数目大小等。(2)实验操作型,例:易水解物质的制取;中和滴定中指示剂选定等。(3)反应推理型,例:判断金属与盐溶液的反应产物;判断盐溶液蒸干时的条件;判断离子方程式的正误;判断离子能否共存等。 |
[例3]蒸干FeCl3水溶液后再强热,得到的固体物质主要是 ( )
A. FeCl3 B. FeCl3·6H2O C. Fe(OH)3 D. Fe2O3
[解析] FeCl3水中发生水解:FeCl3+3H2O 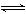 Fe(OH)3 + 3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,最终生成Fe2O3。
Fe(OH)3 + 3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,最终生成Fe2O3。
[答案]D
[规律总结] 易挥发性酸所生成的盐在加热蒸干时水解趋于完全不能得到其晶体。例如:AlCl3、FeCl3;
而高沸点酸所生成的盐,加热蒸干时可以得到相应的晶体,例:CuSO4、NaAlO2。
9.用盐溶液来代替酸碱
8.溶液中,某些离子的除杂,需考虑盐的水解。
7.某些试剂的实验室存放,需要考虑盐的水解。
如:Na2CO3、Na2SiO3等水解呈碱性,不能存放在 的试剂瓶中;NH4F不能存放在玻璃瓶中,应NH4F水解应会产生HF,腐蚀玻璃 。
6.化肥的合理使用,有时需考虑盐的水解。
如:铵态氮肥和草木灰不能混合施用;磷酸二氢钙和草木灰不能混合施用。因草木灰(有效成分K2CO3)水解呈 。
5.选择制备盐的途径时,需考虑盐的水解。如制备Al2S3时,因无法在溶液中制取(会完全水解),只能由干法直接反应制取。
加热蒸干AlCl3、MgCl2、FeCl3等溶液时,得不到AlCl3、MgCl2、FeCl3晶体,必须在蒸发过程中不断通入 气体,以抑制AlCl3、MgCl2、FeCl3的水解,才能得到其固体。
4.配制易水解的盐溶液时,需考虑抑制盐的水解,如在配制强酸弱碱盐溶液时,需滴加几滴 ,来 盐的水解。
3.判断溶液中离子能否大量共存。当有 和 之间能发出双水解反应时, 在溶液中大量共存。
如:Al3+、NH4+与HCO3-、CO32-、SiO32-等,不能在溶液中大量共存。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com