
2.电镀
(1)装置组成:
①电极材料: (如精铜)与电源的正极相连作阳极, (如铁制品)与电源负极相连作阴极
②电解质溶液:用含 的电解质配成溶液(如CuSO4溶液加一些氨水)作电镀液
(2)反应原理:阳极镀层金属(铜)失电子被氧化,转化成离子进入溶液中,阴极镀层金属离子Cu2+得电子被还原在阴极上析出。
(3)特征:电镀过程中电解质CuSO4溶液的浓度几乎不变。
1.电解精炼铜
(1)装置组成
①电极材料: 与电源的正极相连作阳极, 与电源负极相连作阴极
②电解质溶液:用 作电解液
③反应原理:阳极铜以及比铜活泼的杂质金属锌、铁、镍等失电子被氧化,转化成离子进入溶液中,不活泼金属如金和银等沉积在阳极下面形成阳极泥,阴极Cu2+得电子被还原在阴极上析出,其它如Zn2+、Fe2+留在溶液中。
④特征:电解精炼过程中CuSO4溶液的浓度几乎不变,产品纯度高。
4.电极方程式的书写和总的离子反应式的书写
电极方程式是以实际反应的微粒符号来表示的,当水中的氢离子或氢氧根离子参加反应时,在电极反应式中表示时就以H+或OH-表示。
总的离子反应式表示时要注明反应条件-电解,总式的书写要符合离子方程式的书写要求。
[例2] (2007年高考江苏卷,电解)某同学按图所示的装置进行电解实验。下列说法正确的是( )


(A)电解过程中,铜电极上有H2产生
(B)电解初期,主反应方程式为:Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
(C)电解一定时间后,石墨电极上有铜析出
(D)整个电解过程中,H+的浓度不断增大
[解析] 阳极为铜电极,始终为Cu失电子变为Cu2+,故A错;阴极为石墨,先是H+得电子放出H2,后是Cu2+得电子析出Cu,故BC对,在电解过程中消耗H+,因此浓度变小,故D错。
[答案]BC。
[方法技巧]要学会根据放电顺序来分析电极反应,从而解答相关问题。
考点3:电解原理的有关应用。
3.用惰性电极电解电解质溶液的规律
电解水型:
电极反应:阴极 4H++4e-=2H2↑;阳极 4OH--4e-=2H2O+O2↑
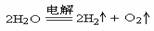 总反应式:
总反应式:
包括高价含氧酸(H2SO4、HNO3)、强碱[NaOH、Ba(OH)2] 、活泼金属的高价含氧酸盐[Na2SO4、K2CO3、Al2(SO4)3]。
(1)分解电解质型:
电极反应式:阴极:amMn++mnae-=amM 阳极:anYm--mnae-=nYa
包括无氧酸(除HF) 、不活泼金属的无氧酸盐溶液(如CuCl2)
(2)放氢生碱型:活泼金属的无氧酸(除氟化物)盐(如NaCl、MgBr2)溶液的电解
以NaCl溶液为例:
电极反应式:阴极 2H++2e-=H2↑;阳极 2Cl--2e-=Cl2↑
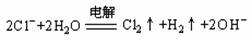 总反应式:
总反应式:
阴极由于H+放电,破坏了水的电离平衡,水的电离程度增大,电极附近溶液中OH-浓度增大,溶液pH值增大,整个电解质溶液碱性增强,pH值增大。
(3)放氧生酸型: (如CuSO4、AgNO3)溶液的电解
以CuSO4溶液为例:
电极反应式:阴极 2Cu2++4e-=2Cu;阳极 4OH--4e-=O2↑+2H2O
 总反应式:
总反应式:
阳极由于OH-放电,破坏了水的电离平衡,水的电离程度增大,电极附近溶液中H+浓度增大,溶液pH值减小,整个电解质溶液酸性增强,pH值减小
2.电极产物的判断
阳极:①根据电极的类型(活泼金属和惰性电极金属);②根据 顺序.
阴极:根据 顺序
1.离子放电顺序的判断
阳离子在阴极得电子顺序与 相反
Ag+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
阴离子在阳极失电子顺序
金属阳极>S2->SO32->I->Br->Cl->OH->高价含氧酸根离子>O2->F
特别提醒:要注意在水溶液中有些离子不发生放电
3.电解原理:
以惰性电极(C、Pt)电解CuCl2溶液为例:

[例1] 能用电解原理说明的问题是 ( )
①电解是电能转变成化学能;②电解是把化学能转变为电能;③电解质溶液的导电是化学变化,金属的导电是物理变化;④不能自发进行的氧化还原反应,通过电解的原理可以实现;⑤任何溶液被电解时必然会导致氧化还原反应的发生
A.①②③④ B.②③⑤ C.③④ D.①③④⑤
[解析]电解质溶液导电时,溶液中的阴阳离子分别向阳极和阴极移动,在两个电极上得失电子,发生氧化还原, 所以电解质溶液的导电过程就是电解过程,此时电源提供电能,把不能自发进行的氧化还原反应转变成现实。金属的导电只是自由电子的定向移动不存在电子得失没有新物质产生,是一种物理过程。
[答案]D
[方法技巧]组合式选择题可以通过排除法进行选择。②和①中只有一个说法是正确的,根据电解原理①是正确的。
考点2电极反应式的书写及溶液浓度和PH的变化
2.电解池的构成:
① 、导线 ②两个电极(金属或非金属导体) ③电解质溶液(或熔融的电解质)
特别提醒:电解池的阴阳极由电源的正负级决定
1.(1)电解的反应原理:在 时在阴、阳两极发生氧化还原反应。
(2)电解池:一种把 的装置
(3)电解的电路工作原理:导线上(外电路)电子从电源的负极流出经导线流向电解池的阴极,电解池的阳极上产生电子经导线流入电源的正极。溶液中(内电路)阴离子移向 ,失去电子,阳离子移向 ,得到电子。
2.原电池的有关计算
电子守恒法是依据氧化剂与还原剂 相等这一原则进行计算的。电子守恒法是氧化还原计算的最基本的方法。计算时可由电极反应式中的氧化剂(或还原剂)与失去的电子(或得电子)之间的关系进行计算。
[例3] (2007年高考理综宁夏卷,原电池)(14分)(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应:______________________;银片上发生的电极反应:_______________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:①产生氢气的体积(标准状况);②通过导线的电量。(已知NA = 6.02×1023 /mol,电子电荷为1.60×10-19 C)
[解析] (1)根据金属活泼性分析得出锌片为负极,银片为正极,相应电极反应为:Zn-2e- = Zn2+;2H++2e- = H2↑。
(2)①锌片与银片减轻,是因与酸反应:
Zn+2H+ = Zn2++H2↑ - 转移2e-
 =
= 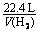 =
=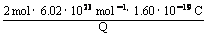
得V(H2) = 4.5 L; Q = 3.8×104 C。
[答案](1)Zn-2e- = Zn2+; 2H++2e- = H2↑(2)V(H2) = 4.5 L; Q = 3.8×104 C。
[规律总结] 根据原电池基本原理分析写出其电极反应式或总方程式,然后根据方程式来计算。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com