
5.某算法的伪代码如下:
S←0
i←1
While i≤100
S←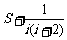
i←i+2
End While
Print S
则输出的结果是 ▲ .
4.在Rt△ABC中,∠A=90°,AB=1,BC=2.在BC边上任取一点M,则∠AMB≥90°的概率为 ▲ .
3.曲线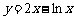 在点(1,2)处的切线方程是 ▲ .
在点(1,2)处的切线方程是 ▲ .
2.已知复数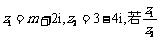 为实数,则实数m的值为 ▲
.
为实数,则实数m的值为 ▲
.
1.命题“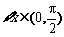 ,
,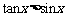 ”的否定是
▲ .
”的否定是
▲ .
21.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中一题,并在相应的答题区域作答。若两题都做,则按A题评分。
A.能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
 ⑴太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式 ▲ 。
⑴太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式 ▲ 。
⑵富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为 ▲ ;1 mol C60分子中σ键的数目为 ▲ 。
 ⑶多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
⑶多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:As ▲ Se(填“>”、“<”或“=”)。
②硫化锌的晶胞中(结构如右图所示),硫离子的配位数是 ▲ 。
③二氧化硒分子的空间构型为 ▲ 。
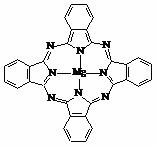
⑷金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图,请在下图中用箭头表示出配位键。
B.实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表。
|
化合物 |
相对分子质量 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100g水 |
|
正丁醇 |
74 |
0.80 |
118.0 |
9 |
|
冰醋酸 |
60 |
1.045 |
118.1 |
互溶 |
|
乙酸正丁酯 |
116 |
0.882 |
126.1 |
0.7 |
请回答有关问题:
Ⅰ.乙酸正丁酯粗产品的制备
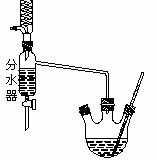 在三孔圆底烧瓶中加入沸石、18.5mL正丁醇和15.4mL冰醋酸,再加3-4滴浓硫酸。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热使之反应。
在三孔圆底烧瓶中加入沸石、18.5mL正丁醇和15.4mL冰醋酸,再加3-4滴浓硫酸。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热使之反应。
⑴有同学拟通过某种谱线鉴定所得产物中是否含有醚类物质。这种谱线为 ▲ 。
⑵反应时加热有利于提高酯的产率,但温度过高酯的产率反而降低,其可能的原因是 ▲ 。
Ⅱ.乙酸正丁酯粗产品的精制
⑴①将圆底烧瓶中的液体转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,该步操作的目的是 ▲ 。
②用分液法可分离上述有机层和水层,分液完成后,取出有机层的操作是 ▲ 。
⑵将酯层进行蒸馏。蒸馏收集乙酸正丁酯产品时,应将温度控制在 ▲ 左右。
Ⅲ.计算产率
称量制得的乙酸正丁酯的质量为12.76g,则乙酸正丁酯的产率为 ▲ 。
20. (10分)右图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
(10分)右图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
①4NH3(g)+5O2(g) 4NO(g) +6H2O(l) △H<0
4NO(g) +6H2O(l) △H<0
②2NO(g)+O2
(g) 2NO2(g) △H<0
2NO2(g) △H<0
③3NO2(g)+H2O(l) 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0
⑴能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 ▲ 。
A.适当升高温度
B.适当增大吸收塔内的压强
C.增大空气中O2的浓度
D.吸收塔内填充瓷环,增大气液接触面
⑵在2L密闭容器内充入0.50 mol NO和0.25 mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数K= ▲ 。
⑶某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/cm3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是 ▲ 。
②每小时从吸收塔淋下的水的质量应是多少吨?
19.(14分)异噁草酮是一种色素抑制类除草剂,它的工业合成路线如下:
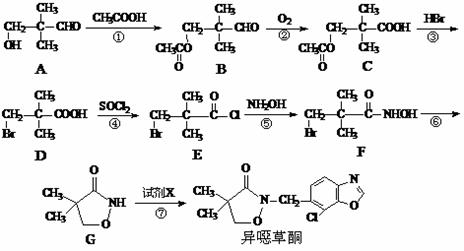
⑴从A→D过程中,反应①的目的是 ▲ 。
⑵写出满足下列条件的A的一种同分异构体的结构简式 ▲ 。
①与A具有相同的官能团;②分子中具有两个手性碳原子。
⑶物质D与NaOH溶液反应的化学方程式为 ▲ 。
⑷由G制备异噁草酮的反应中要加入试剂X(C8H5NOCl2),X的结构简式为 ▲ 。
⑸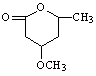 是B的一种重要的同分异构体。请设计合理方案,完成从
是B的一种重要的同分异构体。请设计合理方案,完成从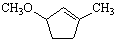 到
到 的合成路线(用合成路线流程图表示,并注明反应条件)。
的合成路线(用合成路线流程图表示,并注明反应条件)。

 ……
……
提示:①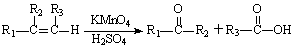 ;
;
②合成过程中无机试剂任选;
③合成路线流程图示例如下:
CH3CH2OH CH2=CH2
CH2=CH2
 CH2-CH2
CH2-CH2
18.(8分)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
⑴已知:N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ/mol
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= ▲ 。
⑵某研究性学习小组在技术人员的指导下,按下列流程探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果。


①实验过程中除空燃比不同外,其他条件:汽车尾气的流速、 ▲ 等必须相同。
②在一定条件下,测得尾气中的主要污染物的转化率与空燃比的关系如右图所示。空燃比约为 ▲ 时,催化剂对汽车尾气的催化效果最好。
⑶CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。
下列说法错误的是 ▲ 。
 A.负极的电极反应式为:CO+O2-―2e-=CO2
A.负极的电极反应式为:CO+O2-―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
17.(10分)利用化学原理可以对工厂排放的废水进行有效检测与合理处理。
⑴染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为 ▲ 。
⑵废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去。
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收。当处理后的废水中c(Ca2+)=2×10-7 mol/L时,溶液中c(PO43-)= ▲ mol/L。
(已知Ksp[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石―鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓。该方法中需要控制污水的pH为7.5-10,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能为 ▲ 。与方法一相比,方法二的优点为 ▲ 。
⑶三氯乙烯在印刷、纺织等行业应用广泛,为了减少其对环境的影响,可将三氯乙烯在二氧化钛薄膜上催化降解,其反应的机理如下:
CCl2=CHCl +·Cl→·CCl2CHCl2
·CCl2CHCl2 + O2→·OOCCl2CHCl2
·OOCCl2CHCl2→·OCCl2CHCl2 + 1/2O2
·OCCl2CHCl2→CHCl2COCl +·Cl
该反应的总化学反应为 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com