
4.某温度下,在固定容积的密闭容器中,可逆反应A(气)+3B(气) 2C(气)达到平衡时,各物质的物质的量之比为:n(A)︰n(B)︰n(C)=2︰2︰1。保持温度不变,以2︰2︰1的物质的量之比再充入A、B、C,若用x (c)表示C的物质的量分数则
2C(气)达到平衡时,各物质的物质的量之比为:n(A)︰n(B)︰n(C)=2︰2︰1。保持温度不变,以2︰2︰1的物质的量之比再充入A、B、C,若用x (c)表示C的物质的量分数则
A.平衡不移动 B.再达到平衡时,n(A)︰n(B)︰n(C)仍为2︰2︰1
C.再达到平衡时,x (c)减小 D.再达到平衡时,x (c)将大于20%
3.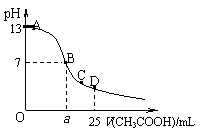 在25mL
0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系的比较正确的是
在25mL
0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系的比较正确的是
A.在A、B间任一点,溶液中一定都有
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有
c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点: c(CH3COO-) >c(Na+)> c(OH-) > c(H+)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
2.阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A.在标准状况下,2.24L HF中所含有的分子数约为6.02×1022
B.pH=1的硫酸氢钠溶液中的硫酸根离子数约为6.02×1022
C.含有6.02×1023个中子的D2O的质量为2.0g
D.3.2克的Cu与足量的浓硝酸反应生成的气体分子数约为6.02×1022
1.下列各项关系正确的是
A.熔点:Mg>Na>Li B.离子半径:Mg2+>Cl->O2-
C.热稳定性:NaHCO3>Na2CO3>CaCO3 D.酸性:HClO4>HBrO4>HIO4
23. 美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图:
美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图:
(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
;反应的平衡常数随温度的变化如表一,
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
;反应的平衡常数随温度的变化如表一,
|
温度/℃ |
400 |
500 |
830 |
1000 |
|
平衡常数K |
10 |
9 |
1 |
0.6 |
从上表可以推断:此反应是_______________ (填“吸”.“放”)热反应。
在830℃下,若开始时向恒容密闭容器中充入CO与HzO均为1 mo1,则达到平衡
后CO的转化率为_____。
(2)此流程的第II步反应CO(g)+H2O(g) H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有
(填实验编号);
H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有
(填实验编号);
|
实验编号 |
N(CO) |
N(H2O) |
n(H2) |
N(CO2) |
|
A |
1 |
5 |
2 |
3 |
|
B |
2 |
2 |
1 |
1 |
|
C |
0.5 |
2 |
1 |
1 |
(3)在一个不传热的固定容积的容器中,判断此流程的第II步反应达到平衡的标志是
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④ 各组分的物质的量浓度不再改变
⑤ 体系的温度不再发生变化
⑥ v(CO2正)= v(H2O逆)
(4)图表示该反应此流程的第II步反应在时刻t 达到平衡.在时刻t
达到平衡.在时刻t 分别因改变某个条件而发生变化的情况:图中时刻t
分别因改变某个条件而发生变化的情况:图中时刻t 发生改变的条件是_________。(写出两种)
发生改变的条件是_________。(写出两种)
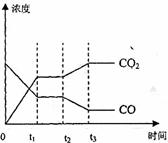
(5)若400℃时,第Ⅱ步反应生成l mol氢气的热量数值为 33.2(单位为kJ),第Ⅰ步反应的热化学方程式为:CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3 kJ·mol-1。
则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
22.某实验小组同学对电化学原理进行了一系列探究活动。
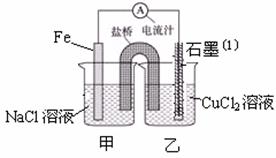
(1)下图为某实验小组依据氧化还原反应:(用离子方程式表示) 设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过 mol电子。
(2)其它条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为 ,
这是由于NH4Cl溶液显 性,(填酸性.碱性或中性)用离子方程式表示溶液显
此性的原因 ,用吸管吸出铁片附近溶液少许至于试
管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式 ,
然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,
同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高的价
态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
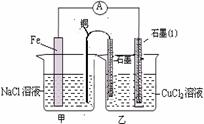 (3)如图其它条件不变,若将盐桥换成弯铜导线与石墨
(3)如图其它条件不变,若将盐桥换成弯铜导线与石墨
相连成n型,如图所示,一段时间后,在甲装置铜
丝附近滴加酚酞试液,现象是 ,
电极反应为 ;乙装置
中石墨(1)为 极(填正.负.阴.阳),乙
装置中与铜线相连石墨电极上发生的反应式
为 ,产物
常用 检验,反应的离子方程式为 。
21.已知A.B为常见的金属单质,C.D为常见的非金属单质,甲.乙.丙为三种常见的化合物,它们之间的相互转化关系如下图所示(部分产物及反应条件没有列出):
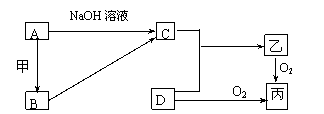
(1)若甲是中学化学中常见的红棕色粉末状固体,则A与甲在一定条件下反应生成B的化学方程式为 ; A与NaOH溶液反应的离 子方程式为 。
(2)若通常D为固态,乙气体有臭鸡蛋气味,水溶液呈弱酸性,丙是一种大气污染物,有刺激性气味。试写出丙与乙反应的化学方程式 。
(3)若乙的水溶液呈弱碱性,并可用作农业化肥,D为空气中含量最多的单质,写出工业上利用C和D反应制备乙的化学方程式 。
20.由金红石(TiO2)制取单质Ti,涉及到的步骤为:
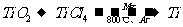
已知:①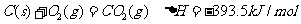
②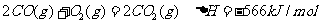
③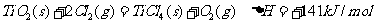
则(1)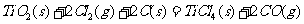 的
的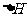 =________________。
=________________。
(2)碳在氧气中不完全燃烧生成CO的热化学方程式为__________ ____________。
19.(Ⅰ)实验室有贮存以下物质的方法,其中正确的是 (填序号)
①氢氟酸保存在细口玻璃瓶中
②浓硝酸用棕色瓶盛放,贮存在阴凉处
③少量液溴可用水封存,防止溴挥发
④氢氧化钠溶液贮存在带磨口玻璃塞的玻璃试剂瓶中
⑤在实验室少量的金属钠保存在煤油中
(Ⅱ)实验室制取0.5mol/L的NaCl溶液500mL,有以下仪器:
①烧杯 ②100mL量筒 ③1000mL容量瓶 ④500mL容量瓶
⑤玻璃棒 ⑥托盘天平(带砝码)
(1)配制时,必须使用的仪器有 (填序号),还缺少的仪器是 。
(2)实验两次用到玻璃棒,其作用分别是 . 。
18.观察下列几个装置示意图,有关叙述正确的是 ( )
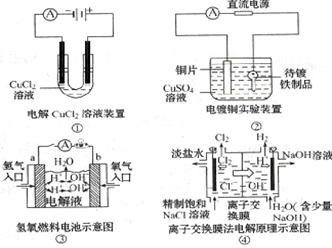
A.装置①中阳极上析出红色固体 B.装置②的待镀铁制品应与电源正极相连
C.装置③闭合电键后,外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子.阴离子.水分子自由通过
第Ⅱ卷(非选择题,共46分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com