
3. 在装有水的烧杯中,用线(绝缘)悬挂一个呈水平方向的由铁和银焊接而成的柱形金属棒,处于平衡状态.如果向水中加入CuSO4 溶液, (溶液的密度变化不考虑)
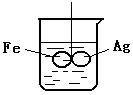
(1)片刻后可观察到的现象是(指悬吊的金属圈) ( )
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
(2)产生上述现象的原因是
__________________________________________________。
(本题考查原电池的工作原理,要正确判断正、负极)
2.氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池。镍氢电池的总反应式是: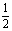 H2+NiO(OH)
H2+NiO(OH)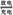 Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,氢气是负极
(本题考查学生在题目创设的新情景中运用所学电化学知识,解决具体问题的能力。)
1.银器皿日久表面逐渐变黑色,这是由于生成硫化银,有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失。试回答:在此原电池反应中,负极发生的反应为________;正极发生的反应为_________;反应过程中产生有臭鸡蛋气味的气体,则原电池总反应方程式为___________________________。
(本题考查学生书写电池电极反应的能力和利用信息处理问题的能力)
3. 腐蚀的快慢的判断方法
电解原理引起的腐蚀>原电池原理引起的腐蚀>有防腐措施的腐蚀;同一种金属:强电解质>弱电解质>非电解质。
典型题点击
2.金属腐蚀与防护
化学腐蚀与电化腐蚀
|
|
化学腐蚀 |
电化腐蚀 |
|
含义 |
金属或合金直接与具有腐蚀性的化学物质接触发生氧化还原反应而消耗的过程 |
不纯金属或合金与电解质溶液接触发生原电池反应而消耗的过程 |
|
得失电子 |
金属直接将电子转移给由氧化性的物质 |
活泼金属将电子间接转移给氧化性较强的物质 |
|
电流 |
无电流产生 |
由微弱的电流产生 |
|
腐蚀现象 |
金属单质 |
较活泼金属 |
|
事例 |
金属与O2、Cl2等物质直接反应 |
钢铁在潮湿的空气中倍腐蚀 |
1. 理解原电池的原理
(1)原电池的定义:把化学能转化为电能的装置叫原电池。
(2)构成条件:
①活泼性不同的两电极②电解质溶液③具有闭合回路
(3)工作原理(电子流向)
较活泼的金属材料作为负极,失去电子,经外电路流向较不活泼金属,再经电解质溶液回到负极,构成闭合回路,电流反向流动
(3)正、负极判断:
负极:电子流出的电极,为较活泼金属电极,发生氧化反应
正极:电子流入的电极,为较不活泼金属或非金属或金属氧化物,发生还原反应
(4)电极反应
电极反应 本质 现象
负极 Zn-2e-=Zn2+ 氧化反应 溶解
正极 2H++2e-=H2↑ 还原反应 气泡
总反应 Zn+2+= Zn2++H2↑
(5)用:①制各种电池;②判断反应速率;③判断金属的活泼性;④金属防护。
22.(10分)氢是重要而清洁的能源。要利用氢气作能源,必须能安全有效的把它储存起来,目前利用金属或合金来储存氢气已获得很大进展。镧La和镍Ni的一种合金就是储氢材料,该合金的一个晶胞如图,属于六方晶胞。该晶胞中的镍原子除一个在中心外,其他都在面上。

(1)写出该合金的化学式 。
(2)该合金晶胞的边长a=511pm、c=397pm以及各边之间的夹角如图所示,计算该合金的密度。
(3)若该合金每个晶胞能吸收3分子氢,吸收氢后晶胞的体积不变,计算该合金吸氢后的密度。
(4)已知液态氢气的密度约为78kg/m3,你认为所吸收的氢与金属之间的结合力比氢分子的结合力强还是弱? 为什么?(已知Ni与La的相对原子质量分别为58.69、138.9)
21.(8分)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂,但膦在水中的溶解度远小于氨,微溶于水。某反应体系中存在下列物质:Cu、H2SO4、CuSO4、PH3、H3PO4、H2O。回答下列问题:
(1)P在元素周期表中的位置是 ,PH3的电子式为 ;
(2)上述反应体系中化学反应方程式为 _________ ,氧化产物是 ;
(3)膦(PH3)在水中的溶解度远小于氨的原因是
_______________________________________________。
20.(10分)SO42-和S2O82-(过二硫酸根离子)结构中,硫原子均位于由氧原子组成四面体的中心,且所有原子的最外层电子均满足8电子结构。已知S2O82-中两个硫原子间存在过氧键,S2O82-有强氧化性。H2S2O8能分步水解产生过氧化氢。
(1)请在下面方框中画出SO42-的立体结构图,分别用实
 心圆点“●”和空心圆点“○”描出氧原子和硫原子的位置。
心圆点“●”和空心圆点“○”描出氧原子和硫原子的位置。
(2)写出过二硫酸的结构简式,并确定氧、硫元素的化合
价______________________________。
(3)分析S2O82-有强氧化性的原因是_______________。
(4)写出H2S2O8在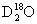 中水解的两步反应的化学方程式。
中水解的两步反应的化学方程式。
第一步:______________________________________。第二步:______________________________________。
19.(10分)随着纳米技术的飞速发展,四氧化三铁纳米颗粒在磁性记录、磁流体、吸波、催化、医药等领域有着广泛的应用。“共沉淀法”是制备四氧化三铁纳米颗粒的常见方法,具体步骤为:将一定量的FeCl2·4H2O和FeCl3·6H2O制成混合溶液加入到烧瓶中,在N2气氛下,滴加氨水、搅拌、水浴恒温至混合液由橙红色逐渐变成黑色,继续搅拌15 min,磁铁分离磁性颗粒,用蒸馏水洗去表面残留的电解质,60℃真空干燥并研磨,可得直径约10 nm Fe3O4磁性颗粒。
(1)“共沉淀法”中N2的作用是___________,制备的总离子反应方程式为________。
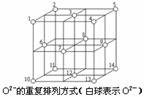 (2)科学研究表明,Fe3O4是由Fe2+、Fe3+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如右图所示,该排列方式中存在着两种类型的由O2-围成的空隙,如1、3、6、7的O2-围成的空隙和3、6、7、8、9、12的O2-围成的空隙,前者为正四面体空隙,后者为正八面体空隙,Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_______,其中有______%正四面体空隙填有Fe3+,有________%正八面体空隙没有被填充。
(2)科学研究表明,Fe3O4是由Fe2+、Fe3+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如右图所示,该排列方式中存在着两种类型的由O2-围成的空隙,如1、3、6、7的O2-围成的空隙和3、6、7、8、9、12的O2-围成的空隙,前者为正四面体空隙,后者为正八面体空隙,Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_______,其中有______%正四面体空隙填有Fe3+,有________%正八面体空隙没有被填充。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com