
14.(12分)X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素最高正价是+7价.回答下列问题:
(1)元素X氢化物的电子式为_________________________________________.
(2)元素Z能与氢元素形成一价阴离子,该阴离子的电子总数是________.
(3)元素W与元素X相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是________.
①常温下W的单质和X的单质状态不同
②W的氢化物比X的氢化物稳定
③一定条件下W和X的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是________(用酸的分子式表示),理由是_____________________________________________________.
解析:根据X原子M层上的电子数是原子核外电子层数的2倍,则X为S;Y原子最外层电子数是次外层电子数的2倍,则Y为C;Z的气态氢化物水溶液呈碱性,则Z为N;W元素的最高正价是+7价,则W为Cl.
答案:(1) 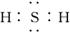 (2)10 (3)Cl ② (4)H2CO3
(2)10 (3)Cl ② (4)H2CO3
只有碳酸是弱酸,其余酸均为强酸
13.(16分)A、B、C为中学化学中常见的三种元素.其中A元素的原子失去1个电子后形成“裸露的质子”,B、C元素可形成多种化合物,原子个数比为1∶2的就有两种,且C元素的原子最外层电子数为次外层电子数的3倍.
(1)A、B、C三种元素分别为:A________,B__________,C__________.(写元素名称)
(2)由A、B两元素形成的一种常见化合物为________(填化学式),其水溶液呈________性,用方程式来解释其原因:______________________________________.
(3)B、C元素可形成多种化合物,试列举其中的三种物质的化学式为________、________、________.
(4)由A、B、C三种元素形成的化合物的化学式为______、________、________等,其中的一种物质在浓度较大时可使Fe、Al等金属钝化,则该物质的浓溶液与Cu反应的离子方程式为_________________________________________________.
解析:(1)由A元素的原子失去1个电子就变为“裸露的质子”知A为氢元素;由C 元素的原子最外层电子数为次外层电子数的3倍知,C为氧元素,再结合信息知B为氮元素.

 (2)N、H形成化合物,常见的为NH3,其在水中的变化为:NH3+H2O
NH3·H2O NH+OH-,而使溶液呈碱性.
(2)N、H形成化合物,常见的为NH3,其在水中的变化为:NH3+H2O
NH3·H2O NH+OH-,而使溶液呈碱性.
(3)氮元素从+1价到+5价都可与氧形成化合物,如N2O、NO、N2O3、NO2(N2O4)、N2O5等.
(4)N、H、O三种元素形成的化合物为HNO3、HNO2、NH4NO3等,Cu与浓HNO3反应的化学方程式为:
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O.
答案:(1)氢 氮 氧 (2)NH3 碱
NH3+H2ONH3·H2ONH+OH-
(3)N2O NO N2O3 NO2 N2O4 N2O5(任写三种)
(4)HNO3 HNO2 NH4NO3(NH4NO2)
Cu+4H++2NO===Cu2++2NO2↑+2H2O
12.(12分)现有部分元素的性质与原子(或分子)结构如下表:
|
元素编号 |
元素性质与原子(或分子)结构 |
|
T |
最外层电子数是次外层电子数的3倍 |
|
X |
常温下单质为双原子分子,分子中含有3对共用电子 |
|
Y |
M层比K层少1个电子 |
|
Z |
第三周期元素的简单阳离子中半径最小 |
(1)写出元素T的原子结构示意图:_______________________________________.
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既含离子键又含非极性共价键的化合物,写出该化合物的电子式:_________________________________________________.
(4)元素T和元素X以原子个数比2∶1化合形成化合物Q,元素X与氢元素以原子个数比1∶2化合形成常用于火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式_______________________________________________________________________
________________________________________________________________________.
 解析:由表中信息可知,T为氧元素,X为氮元素,Y为钠元素,Z为铝元素.Na比Al金属性强,相关事实为:Na与水反应比Al剧烈;最高价氧化物对应水化物的碱性NaOH比Al(OH)3强.上述元素中,由其中两种元素形成的既含离子键又含非极性共价键的化合物常见的是Na2O2.氧与氮形成的原子个数比为2∶1的化合物Q是NO2,氮与氢形成的原子个数比为1∶2的化合物是N2H4,两者反应可生成N2和H2O.
解析:由表中信息可知,T为氧元素,X为氮元素,Y为钠元素,Z为铝元素.Na比Al金属性强,相关事实为:Na与水反应比Al剧烈;最高价氧化物对应水化物的碱性NaOH比Al(OH)3强.上述元素中,由其中两种元素形成的既含离子键又含非极性共价键的化合物常见的是Na2O2.氧与氮形成的原子个数比为2∶1的化合物Q是NO2,氮与氢形成的原子个数比为1∶2的化合物是N2H4,两者反应可生成N2和H2O.
答案:(1) (2)Na cd
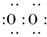
(3)Na+[ ]2-Na+
(4)2N2H4+2NO2===3N2+4H2O
11.(10分)(2009·宿州模拟)有①-⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.
|
② |
|
|
|
|
|
|
⑦ |
⑧ |
(1)元素②在周期表中的位置为________;②、⑦、⑧三种元素最高价氧化物对应水化物的酸性由强到弱的顺序是____________________________(用化学式表示).
(2)如图所示,甲、乙、丙、丁均为①-⑧中某些元素形成的单质或化合物,反应a为置换反应,反应b为化合反应.单质乙与单质丙所含元素位于同一主族,试写出符合条件的反应a的两个化学方程式_____________________________、
______________________________________________________________.
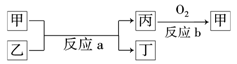
解析:由元素②所处主族正中间,所以②位于第二周期第ⅣA族,可知②为碳元素,则⑦为硫元素,⑧为氯元素,②⑦⑧三种元素最高价氧化物对应水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3.短周期元素中能发生主族间的置换反应的有①2Na+2H2O===2NaOH+H2↑,②SiO2+2C高温Si+2CO↑,③2H2S+O2点燃2H2O+2S,符合上述条件的是①、②.
答案:(1)第二周期第ⅣA族 HClO4>H2SO4>H2CO3
(2)2Na+2H2O===2NaOH+H2↑ SiO2+2C高温Si+2CO↑
10.目前人类已发现的110多种元素中,除22种非金属元素外,大多数为金属元素,下列对金属元素与非金属元素的相关判断中正确的是 ( )
A.金属元素的阳离子被还原一定得到对应的单质
B.非金属性越强的元素,其气态氢化物越稳定
C.同主族元素的单质其熔点随着原子序数的增加而升高
D.金属单质在反应中只能作还原剂,非金属单质在反应中只能作氧化剂
解析:Fe3+被还原可以得到Fe2+,A错误;同主族金属元素的单质随着核电荷数的增加,熔点降低,C错误;Cl2与水的反应中,Cl2既是氧化剂又是还原剂,D错误.
答案:B
9.(2009·北京崇文期末)右图为元素周期表前四周期的一部分,
且X、Y、Z、R和W为主族元素.下列说法正确的是( )
A.Y单质一定既能与盐酸又能与氢氧化钠溶液反应
B.五种元素的原子最外层电子数一定都大于2
C.单质X的熔点一定比单质Z的熔点高
D.R的最高价氧化物对应的水化物一定是强酸
解析:由元素周期表知,这五种主族元素为ⅢA-ⅦA之间的主族元素,最外层电子数一定都大于2,B项正确;Y元素是Al或者Si,Si只与NaOH溶液反应,A项错误;X元素是C或N,Z元素是Si或P,P的熔点比N2高,C项错误;R元素是P或S,H3PO4不是强酸,D项错误.
答案:B
8.四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是 ( )
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物碱性X>Y
A.②③ B.③
C.①②③④ D.①②③
解析:由题意知:X、Y位于R、Z的下一周期,X、Y分别位于第m、n主族,R、Z分别位于第(8-m)、(8-n)主族,a-m=b-n,即a-b=m-n,①错误;②③正确;最高价氧化物对应水化物碱性Y>X,④错误.
答案:A
|
|
X |
|
|
|
Y |
Z |
R |
|
|
|
|
|
W |
7.(2009·海南高考)门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确.根据元素周期律,下列有关X性质的描述中错误的是 ( )
A.X单质不易与水反应
B.XO2可被碳或氢还原为X
C.XCl4的沸点比SiCl4的高
D.XH4的稳定性比SiH4的高
解析:根据元素周期律,同族元素随着原子序数的增加,非金属性减弱,气态氢化物的稳定性减弱.由硅的性质类推可知,稳定性SiH4>XH4.
答案:D
6.(2009·山东高考)元素在周期表中的位置,反映了元素的原子结构和元素的性质.下列说法正确的是 ( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
解析:在元素周期表中金属与非金属的分界线附近的元素可能既表现金属性,又表现非金属性,A不正确;短周期元素中的Li失去电子后,最外层只有2个电子,C不正确;同一主族元素的原子,最外层电子数一定相同,但随着电子层数的增加,其化学性质发生递变,D不正确.
答案:B
5.(2009·海南高考)同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是 ( )
A.单质的化学活泼性:W<X<Y<Z
B.原子最外层电子数:W<X<Y<Z
C.单质的氧化能力:W<X<Y<Z
D.元素的最高化合价:W<X<Y<Z
解析:同周期元素从左到右,金属单质的化学活泼性逐渐减弱,而非金属单质的化学活泼性逐渐增强,A错误;同周期元素从左到右,原子的最外层电子数逐渐增高,B正确;同周期从左到右(除稀有气体),单质的氧化能力逐渐增强,当Z为稀有气体时,其氧化能力最弱,C错误;元素的最高化合价等于原子的最外层电子数,但O无最高正价,F无正价,D错误.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com