
1.(山东省文登市天福山中学2009届高三第四次月考)下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不记)。其中能表示等质量的氢气与氦气的是( )
A. B.
B.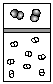 C.
C. D.
D.
[解析]根据阿伏伽德罗定律的推论,同温同压下,分子数之比等于气体体积比,只有A正确。
[答案]A
16.(2008天津卷)(1)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+= __CO2+__Mn2++__H2O
(2)称取6.0 g含H2C2O4·2H2O、KOH、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O的质量分数为___。KHC2O4的质量分数为___。
[解析](1)标出化合价升降:C2O42- CO2,MnO4-
CO2,MnO4- Mn2+;根据化合价变化,求2和5的最小公倍数:
Mn2+;根据化合价变化,求2和5的最小公倍数: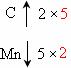 ,可知在C2O42-前加系数5,在MnO4-前加系数2,然后根据电荷守恒和原子守恒,利用观察法,可得配平方程式:5C2O42-+2MnO4-+16H+=1OCO2↑+2Mn2++8H2O。
,可知在C2O42-前加系数5,在MnO4-前加系数2,然后根据电荷守恒和原子守恒,利用观察法,可得配平方程式:5C2O42-+2MnO4-+16H+=1OCO2↑+2Mn2++8H2O。
(2)①加NaOH变为浅红色,说明溶液呈弱碱性,则溶液中被中和的n(H+)=n(OH-)=0.25mol·L-1×0.02L=0.005mol。
②加入酸性KMnO4将C2O42-氧化,恰好反应时,溶液由无色变成紫红色;根据方程式可得关系式:5C2O42- 2MnO4-,n(C2O42-)=×n(KMnO4)=×0.1mol·L-1×0.016L=0.004mol。
2MnO4-,n(C2O42-)=×n(KMnO4)=×0.1mol·L-1×0.016L=0.004mol。
③因为和NaOH反应时,H+来源于H2C2O4·2H2O和KHC2O4,而和KMnO4反应时,C2O42-也来源于二者。设试样中含H2C2O4·2H2O、KHC2O4的物质的量分别为x、y,根据题意得:
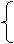 x+y=0.04
x+y=0.04
2x+y=0. 05
解之得:x=0.01mol,y=0.03mol。故m(H2C2O4·2H2O)=126g·mol-1×0.01mol=1.26g,则试样中H2C2O4·2H2O
的质量分数=×100%=21%;m(KHC2O4)=
128g·mol-1×0.03mol=3.84g,故 =×100%=64%。
=×100%=64%。
[答案](1)5 2 16 10 2 8 (2)①0.005 ②无色 紫红色 0.004 ③21% 64%。
[考点分析]以氧化还原反应为载体,考查物质的量应用到化学方程式的计算。
[专题突破]
15.(09江南十校高三第五次月考)取一定量的Na2CO3、NaHCO3和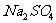 的混合物与250ml,100mo1·L-1过量盐酸反应,生成2016LCO2(标准状况),然后加入500ml,0100mo1L-1Ba(OH)2溶液,得到沉淀的质量为233g,溶液中过量的碱用100ml,100mo1·L-1盐酸恰好完全中和。计算混合物中各物质的质量21世纪教育网
的混合物与250ml,100mo1·L-1过量盐酸反应,生成2016LCO2(标准状况),然后加入500ml,0100mo1L-1Ba(OH)2溶液,得到沉淀的质量为233g,溶液中过量的碱用100ml,100mo1·L-1盐酸恰好完全中和。计算混合物中各物质的质量21世纪教育网
[解析及答案]混合物中Na2SO4的质量=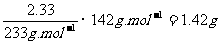
设混合物中NaCO3和NaHCO3的物质的量分别为x和y,反应中放出的CO2物质的量
=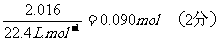
与Na2CO3、NaHCO3反应的盐酸的物质的量为
0250L×100mo1L-1-0500L0100 mo1L-1×2+0010L×100 mo1L-1=0160mol
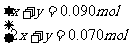
解得:X=0070mol Y=0020mol
Na2CO3质量=0070mol×106g mo1L-1=742g NaHCO3质量=0020mol×84g mo1L-1=168g
考点分析:本题通过物质之间的相互转化,考查将物质的量应用于化学反应方程式的计算。
14.下列说法或计算正确的是 ( )
A. 采用加热蒸发溶剂的方法可以使浓度为2mol/L的氢溴酸溶液的浓度变为4mol/L
B. m g H2和n g He,在同温同压下密度之比等于m:n
C. 只有标准状况下,等物质的量的乙烯和一氧化碳所含的分子数才相等
D. 将a%的某物质的水溶液加热蒸发掉m g水(溶质不挥发,且蒸发过程中无溶质析出),所得溶液体积为V L,溶质的质量分数为蒸发前的2倍.设溶质的相对分子质量为M,则蒸发后所得溶液的物质的量浓度为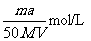
[解析]A错,因为HBr比水容易挥发,所以加热蒸发,浓度更低;
B错,因为ρ=M/Vm,所以同温同压下ρ(H2)/ρ(He)=Μ(H2)/Μ(He)=2/4=1/2;
C错,根据n=N/NA,物质的量相等,无论在什么条件下分子数都相等;
D正确,蒸发掉m g水溶质的质量分数为蒸发前的2倍,则原来溶液质量为2mg,
n=2m×a%/M mol=am/50M mol,C=n/V=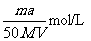
[答案]D
[考点分析]本题考查溶液浓缩、阿伏伽德罗定律的推论等知识点。
13.(2008南通一模)阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是
A.4 g重水(D2O)中所含质子数为0.2×6.02×1023
B.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2×6.02×1023
C.4.48 L H2和O2的混合气体中所含分子数为0.2×6.02×1023
D.0.2 mol Cl2溶解于等体积的水中,转移电子数为0.2×6.02×1023
[解析]4 g(0.2 mol)重水含2×6.02×1023个质子;4.48 L H2和O2的混合物若在标准状况下所含分子数就是0.2×6.02×1023;Cl2与H2O的反应是可逆的,0.2 mol Cl2与水反应则转移电子数小于0.2×6.02×102321世纪教育网
[答案]B
[考点分析]本题以阿伏伽德罗常数的考查为载体,考查学生对化学基本概念的掌握应用程度和相关计算能力。
12.(甘肃省兰州一中2008-2009高三上学期第三次月考)溶液的配制过程 能引起浓度偏高的是
①用1g 98%的浓硫酸加4g水配19.6%的硫酸
②配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线。
③10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
④在80mL水中加入18.4mol/L的硫酸20mL,配制3.68mol/L的硫酸溶液
⑤质量分数为5x%和x%的两种氨水等体积混合配成3x%的氨水。
A.①③⑤ B.②④⑤ C.③④ D.④⑤
[解析]①1×98%/(1+4)=19.6%;②没有误差;③10%的硫酸和90%的硫酸的密度分别为ρ1、ρ2,ρ1<ρ2,(Vρ1×10%+ Vρ2×90%)/( Vρ1+ Vρ2)=
10%+ Vρ2×80%/( Vρ1+ Vρ2)=10%+ 2Vρ2×40%/( Vρ1+ Vρ2)>10%+40%=50%;
④混合后溶液的体积小于100ml,浓度偏高;⑤解法同③,偏低。
[答案]C
[考点分析]本题主要考查一定物质的量浓度的溶液配制的误差分析。
11.(2008海南卷)在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是:
A. 甲的分子数比乙的分子数多
B. 甲的物质的量比乙的物质的量少
C. 甲的摩尔体积比乙的摩尔体积小
D. 甲的相对分子质量比乙的相对分子质量小
[解析]温度和压强相同时,气体摩尔体积相同,又等质量且甲的密度大于乙的密度,所以甲中气体的体积小于乙中气体体积,因此甲中气体的分子数比乙的分子数少,.甲的物质的量比乙的物质的量小,甲的相对分子质量比乙的相对分子质量大。
[答案]B
[考点分析]本题考查阿伏伽德罗定律的推论。
10.(2008山东卷)NA 代表阿伏加德罗常数,下列叙述错误的是 ( )
A. 10 mL 质量分数为 98 %的 H2SO4,用水稀释至 100 mL H2SO4 的质量分数为 9.8 %
B. 在 H2O2 + Cl2 = 2HCl + O2 反应中,每生成 32g氧气,则转移 2 NA 个电子
C.标准状况下,分子数为NA的 CO 、C2H4 混合气体体积约为 22.4L ,质量为 28g
D.一定温度下, 1 L 0.5 mol/L NH4Cl 溶液与 2 L 0. 25mol/L NH4Cl 溶液含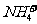 物质的量不同
物质的量不同
[解析]A中根据C=1000dω/W,其中d是溶液密度,ω是溶液质量分数,稀释至100ml,物质的量浓度变为原来的1/10,又硫酸溶液的浓度越大,密度越大,所以H2SO4 的质量分数大于 9.8 %;B中根据反应可知H2O2全部作还原剂,所以每生成 32g氧气即1mol,则转移 2 NA 个电子;C中注意CO 、C2H4的式量相等;D中两份溶液中铵根离子的浓度不同,水解程度不同,所以NH4+ 物质的量不同21世纪教育网
[答案]A
[考点分析]本题以阿伏伽德罗常数的考查为载体,具体考查溶液的稀释、电子的转移、分子数与质量的关系、溶液中因水解程度不同离子浓度的不同等知识点。
9.(2008扬州四调)某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录了t℃的4份相同的硫酸铜溶液中加入的无水硫酸铜的质量以及析出的硫酸铜晶体(CuSO4·5H2O)的质量(温度维持不变)的实验数据:
|
硫酸铜溶液 |
① |
② |
③ |
④ |
|
加入的无水硫酸铜(g) |
2.50 |
5.00 |
8.00 |
11.0 |
|
析出的硫酸铜晶体(g) |
0.10 |
4.60 |
10.0 |
15.4 |
当加入a g(5<a<11)无水硫酸铜时,析出硫酸铜晶体的质量(g)为
A.1.8a-4.4 B.1.8a-8 C.1.8a-4.6 D.1.8a-0.1
[解析]根据图中数据可知,原溶液不饱和,当溶液达饱和后,相比①所增加的固体量与多析出的晶体质量成正比,当加入5.00g时,相当于比①多加2.50g,此时多析出4.50g,当加入ag时,相当于比①多加入(a-2.50)g,所以设多析出质量X,即根据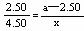 可得X=(1.8a-4.5)g,再加上①析出的0.1g,所以选 A.
可得X=(1.8a-4.5)g,再加上①析出的0.1g,所以选 A.
[答案]A
[考点分析]本题考查溶解度的相关计算。
8.(上海卢湾区2008届第一学期高三年级期末考试)常温下,在密闭容器里分别充入两种气体各0.1 mol,在一定条件下充分反应后,恢复到原温度时,压强降低为开始时的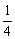 。则原混合气体可能是。
。则原混合气体可能是。
A.H2和O2 B.HCl和NH3
C.H2和Cl2 D.CO和O2
[解析]A中,根据2H2+O2=2H2O,剩余气体0.05moL的氧气;B中NH3+HCl=NH4Cl,剩余气体为零;C中,H2+Cl2=2HCl
,气体物质的量为0.2mol;D中,2CO+O2=2CO2,
剩余氧气0.05mol,生成0.1moL的二氧化碳,总气体是0.15mol。根据同温同体积气体,压强比等于物质的量比,A压强降低为开始时的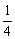 。
。
[答案]A
[考点分析]本题考查阿伏伽德罗定律的推论21世纪教育网
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com