
(7)酒精灯和酒精喷灯点燃的顺序是 。
(8)为了防止甲中气体收集装置发生的安全问题,可以在不增减仪器种类、数量,不改变其连接方式的前提下进行简单的改造,请在甲中画出你改造之处的示意图。
答案 (1)防止暴沸;(2)增加铁粉与水蒸气的接触面积;(3)容易发生水的倒吸;
(4)试管中有气泡产生;
(5)将收集到气体的试管用拇指堵住,管口对着酒精灯火焰,松开拇指,如果能产生轻微的响声,则证明有氢气生成;(2分)
(6)Fea/56O(b-a)/16(2分)
(7)先点燃酒精灯再点燃洒精喷灯;
(8)图略(将试管中的导管画长,接近试管底部。(2分)
6.(08山东省威海市08质量检测)(8分)测定一定体积的NaOH和Na2CO3混合溶液中NaOH的含量:取20mL溶液,加入足量BaCl2溶液后,滴入几滴酚酞,再用0.10mol·L-1盐酸进行滴定。
(1)用盐酸进行滴定之前不需要过滤以除去BaCO3的的理由是
;
(2)达到终点时,溶液的颜色变化是 ;
(3)达到终点时消耗25.0mL 的HCl,则原混合液中NaOH的含量为 g/mL;
(4)若向含有大量BaCO3固体的浊液中,分别加入下列试剂,则发生的变化是:
①加入少量BaCl2固体,则c(Ba2+) c(CO32+) (填“增大”、“减少”)。
②加入少量稀盐酸,则Ksp(BaCO3) (填“增大”、“减少”或“不变”)。 答案
(1)酚酞变色时,pH大于7,此时BaCO3不可能溶解。
(2)红色变为无色
(3)5×10-3
(4)①增大 减少 ②不变
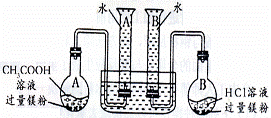
(4)甲同学可以证明两者发生反应的现象是 ;
(5)从反应物元素的种类分析,生成的气体可能是氢气,进一步验证的方法是
;
(6)当玻璃管中的铁粉充分反应后,停止实验,称量反应后固体产物质量为b,则固体产物的化学式为 (用字母表示)。
(1)在水蒸气的生成装置中乙同学在烧瓶底部放置了几片碎瓷片,其作用是 ;
(2)在反应装置中甲同学在硬质玻璃管中放入的是还原铁粉和石棉绒,石棉绒的作用是
;
(3)在收集装置中甲同学用的是排水集气法,这种方法存在的安全隐患是 ;
8.[江苏省前黄高级中学国际分校09姐上学期综合练习三]醋酸是重要的一元酸,在有机和无机反应中都有应用。
(1)在酯化反应的实验中,乙酸、乙醇的用量和平衡时乙酸乙酯的生成量如下表
|
反应 |
乙醇/kmol |
乙酸/kmol |
乙酸乙酯/kmol |
|
1 |
2 |
2 |
1.33 |
|
2 |
3 |
2 |
1.57 |
|
3 |
4 |
2 |
X |
|
4 |
5 |
2 |
1.76 |
①该酯化反应的平衡常数K的表达式为:K=______________________________
②由表中数据推测,数值X的范围是________。推断的依据为
 ③假设乙醇的价格为500元/k mol,乙酸乙酯的价格为1600 元/kmol,同反应2相比,反应3的经济效益________(填:增加或减少)
③假设乙醇的价格为500元/k mol,乙酸乙酯的价格为1600 元/kmol,同反应2相比,反应3的经济效益________(填:增加或减少)
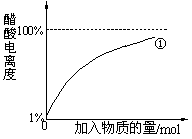
(2)10 mL 0.10 mol·L-1的稀醋酸中存在着平衡:CH3COOH CH3COO-+H+。①向稀醋酸中不断加水②向稀醋酸中慢慢滴加0.10
mol·L-1的稀氢氧化钠溶液。①中醋酸电离度的变化图线已画出,请你在下图中画出②过程中醋酸电离度的变化图线。
CH3COO-+H+。①向稀醋酸中不断加水②向稀醋酸中慢慢滴加0.10
mol·L-1的稀氢氧化钠溶液。①中醋酸电离度的变化图线已画出,请你在下图中画出②过程中醋酸电离度的变化图线。
7、[2008-2009年度第一学期江苏省前黄高级中学期末考] (11分)工业合成氨的反应为:N2(g)
+ 3H 2(g)  2NH3(g); △H<0
2NH3(g); △H<0
工业合成氨生产示意图如图所示。
(1)写出该反应的化学平衡常数表达式:K= _______________________。
随着温度升高,K值_________ (填增大、减小、不变)
(2)Y的主要成分为__________________;
(3)化工生产条件选定的主要原因是(选填字母序号)__________;
A.温度、压强对化学平衡的影响; B.铁触媒在该温度时活性大;
C.工业生产受动力、材料、设备等条件的限制。
(4)改变反应条件,会使平衡发生移动。如下图像表示随条件改变,
氨气的百分含量的变化趋势。
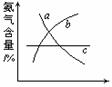
当横坐标为压强时,变化趋势正确的是(选填字母序号)_________,
当横坐标为温度时,变化趋势正确的是(选填字母序号) 。
(5)如图所示三个容积相同的容器①、②、③,若起始温度相同,分别向三个容器中充入①中3mol
H2和1mol N2;②中2mol
NH3;③中1.5mol
H2和0.5mol N2和1mol
NH3;一定条件下反应,达到平衡时各容器中NH3物质的百分含量由大到小的顺序为 (填容器编号)
(6)合成氨工厂常通过测定反应前后的混合气体密度来确定氮的转化率。某工厂测得进入合成塔中N2、H2的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体密度为0.693g/L。则该合成氨厂N2的转化率为
。 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
答案.(1)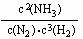 (1分),
减小 (1分)
(1分),
减小 (1分)
(2)N2、H2 (1分)
(3)BC (2分)
(4)b, (1分) a (1分)
(5)①<②<③ (2分) (6)25% (2分)
6、[09届江苏省前黄高级中学国际分校期末化学综合练习四]在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g) 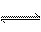 2C(g)+D(s),已知将2molA和1molB充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中体积分数为n% 。
2C(g)+D(s),已知将2molA和1molB充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中体积分数为n% 。
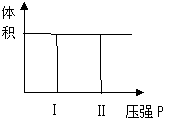 (1)若把2molA和1molB充入该容器时,处于状态Ⅰ,达到平衡时处于状态Ⅱ(如下图),则该反应的正反应是 反应(填:吸热;放热)
(1)若把2molA和1molB充入该容器时,处于状态Ⅰ,达到平衡时处于状态Ⅱ(如下图),则该反应的正反应是 反应(填:吸热;放热)
(2)若降低原平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是: 。
(3)若将原容器改为容积可变的容器,在一定温度和常压下,将2molA和1molB充入该容器中,建立平衡之后,B的物质的量浓度为a mol/L。
Ⅰ、现持续增大压强,当:
①当压强为原来1.5倍时,B的平衡时物质的量浓度为m mol/L,测得m<1.5a;
②当压强为原来10倍时,B的平衡时物质的量浓度为n mol/L,测得n >10 a;
试解释形成第②种结果的可能原因: 。
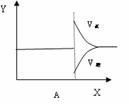
Ⅱ、再将2molA和1molB充入该容器中,则反应速率(Y)与时间(X)关系图象可表示为___。
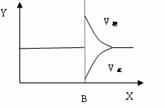
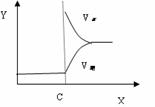
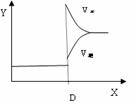
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
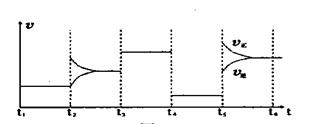
(4)下图为t2时刻后在原平衡的基础上改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知各阶段平衡时对应的平衡常数如下表所示:
|
t1-t2 |
t2-t3 |
t3-t4 |
t4-t5 |
t5-t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1、K2、K3、K4、K5之间的关系为 (用“>”、“<”或“=”连接)
(5)若维持该题条件不变,仅从生成物开始配比,要求达到平衡时,C的物质的量仍为Wmol。则D的起始物质的量n(D) 应满足的条件是 ,(用含有W的代数式表示)
答案..①放热反应
②M(D)=原平衡状态的相对分子质量
③I A转化为非气态,增大压强,平衡左移
Ⅱ A
④K1=K2=K3=K4>K5
⑤n(D)=(2-W)/2
5.[09届江苏省前黄高级中学国际分校期末化学综合练习四](10分)工业合成氨与制备硝酸一般可连续生产,流程如下:
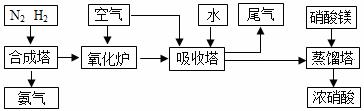
(1)希腊阿里斯多德大学的 George Marnellos 和 Michael Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式 。
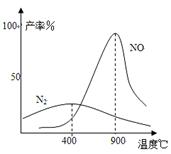 (2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图所示):
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图所示):
4NH3+5O2 4NO+6H2O K1=1×1053(900℃)
4NO+6H2O K1=1×1053(900℃)
4NH3+3O2 2N2+6H2O K2=1×1067(900℃)
2N2+6H2O K2=1×1067(900℃)
温度较低时以生成 为主,温度高于900℃时,
NO产率下降的原因 。
吸收塔中需要补充空气的原因 。
(3)尾气处理时小型化工厂常用尿素作为氮氧化物的吸收
剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NO和NO2的去除率高达99.95%。其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素[CO(NH2)2]反应生成CO2 和N2请写出有关反应化学方程式:
, 。
答案.(1) N2+6e-+6H+=2NH3 (2分)w.w.w.k.s.5.u. c.o.m
(2) N2 (1分) 生成NO的反应为放热反应,升高温度转化率下降 (2分)
进一步与NO反应生成硝酸(2分)
(3) NO+NO2+H2O=2HNO2;(1分) CO(NH2)2+2HNO2=CO2+2N2+3H2O(2分)
4. [ 江苏省泗阳致远中学2009届高三化学综合模拟试卷二](12分)煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
 已知:CO(g)+H2(g) H2(g)+CO2(g)平衡常数随温度的变化如下表:
已知:CO(g)+H2(g) H2(g)+CO2(g)平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数Ke |
9.94 |
9 |
1 |
试回答下列问题
(1)上述正向反应是: ▲ 反应(填“放热”或“吸热”)
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 ▲ (选填A、B、C、D、E)。
|
|
n(CO) |
n(H2O) |
n(H2) |
n(CO2) |
|
A |
1 |
5 |
2 |
3 |
|
B |
2 |
2 |
1 |
1 |
|
C |
3 |
3 |
0 |
0 |
|
D |
0.5 |
2 |
1 |
1 |
|
E |
3 |
1 |
2 |
1 |
 (3)已知在一定温度下,C(s)+CO2(g) 2CO(g)平衡常数K;
(3)已知在一定温度下,C(s)+CO2(g) 2CO(g)平衡常数K;
 C(s)+H2O(g) CO(g)+H2(g) 平衡常数K1;
C(s)+H2O(g) CO(g)+H2(g) 平衡常数K1;
 CO(g)+H2O(g) H2(g)+CO2(g)平衡常数K2
CO(g)+H2O(g) H2(g)+CO2(g)平衡常数K2
则K、K1、K2之间的关系是: ▲ 。
(4)若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为: ▲ 。
(5)若反应在800℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y= ▲ 。
(6)在VL密闭容器中通入10 molCO和10 mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧为283 kJ/mol,H2燃烧热为286/kJmol),则T℃平衡常数K= ▲ 。
答案.(1)放热 (2)BCE (3)K=K1/K2
(4)75% (5)y=x (6)4/9
3. [ 江苏省泗阳致远中学2009届高三化学综合模拟试卷二]在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:
 2A(?)+ B(?) xC(g) ΔH<0
2A(?)+ B(?) xC(g) ΔH<0
平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是[ BC]
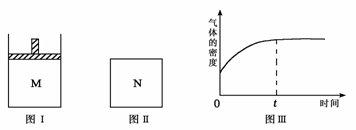
A.x =4
B.若N中气体的密度如图Ⅲ所示,则A、B有一种是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
2、[ 江苏省泗阳致远中学2009届高三化学综合模拟试卷二].今有室温下四种溶液,有关叙述不正确的是
|
|
① |
② |
③ |
④ |
|
pH |
11 |
11 |
3 |
3 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH ①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4, 则Va ∶Vb= 11∶9
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com