
5.确定化学式的计算:确定复杂化学式的计算特点--常给出一种成分复杂的化合物及发生化学反应的过程,通过分析、推理、计算确定化学式。此类题目将计算、推断融为一体,能力层次高,在综合计算中多有出现。解这类题的方法:一是根据题目所给化学反应过程,分析判断化合物的成分;二是通过计算确定各成分之间量的关系。
[典型例析]
例1:某含氧酸的化学式是HnRO3n-2,该酸的酸酐可能是
A.Cl2O B.N2O5 C.SO3 D.CO2
变式训练:随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。已知钒的原子序数是23,回答下列问题:
(1)钒被认为是一种稀土元素,广泛存在于各种矿物中。钾钒铀矿中的钒原子最外层已达8电子稳定结构,其化学式为K2H6U2V2O15,若用氧化物的形式表示,该化合物的化学式为_____________。
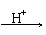 (2)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO2+,再用盐酸、硫酸亚铁、草酸等测定钒。总反应可表示为:
(2)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO2+,再用盐酸、硫酸亚铁、草酸等测定钒。总反应可表示为:
VO2++H2C2O4 VO++CO2+H2O(未配平)
其中还原剂是__________。若消耗0.9 g草酸,所对应钒元素质量是_____________ g。
例2:R为元素周期表中不超过20号元素中的金属元素,取16.15gR的氯化物和溴化物的混合物,使之与足量的AgNO3溶液反应,共生成32.30g卤化银沉淀。试通过计算确定R元素的名称。
变式训练:现有0.1mol某有机物在8.96 LO2中充分燃烧,气体体积变为6.72 L,通过足量碱石灰吸收后剩余2.24 L(气体体积均在标准状态下测定)
(1)燃烧后所得混合气体中CO2的物质的量为__________,2.24L剩余气体可能是______或__________;
(2)若A是烃,其化学式可能是__________或_________;若A是烃的衍生物 ,其化学式可能是____________或______________。
(3)若A是由丁醛(C4H8O)与气体B等物质的量混合得到,试求气体B的化学式。
例3:某盐的化学式为AxB(EO4)y·zH2O,其中A、B均为金属元素, x、y、z均为正整数,且x+y+z=10。(1)称40.2g上述该盐的晶体,加热,使之失水,至质量恒定时固体的质量减少10.8g;
(2)将所得固体溶于水,配成200mL溶液,从中取出20mL,向其中加入过量的Ba(OH)2溶液,EO4离子和B离子全部沉淀。经过滤、洗涤、干燥后得5.24g固体;
(3)向5.24g固体中加入过量的盐酸,固体的质量减少了0.58g。请确定该晶体的化学式。
变式训练:水合碳酸铵(NH4)2CO3·H2O是一种白色晶体,在空气中能逐渐发生变化并生成碳酸氢铵;在58℃时可分解为氨、二氧化碳和水。现有一包样品,为确定它的成分,进行以下实验:
①取样品27.2g,加热,样品全部分解成气体A;
②将气体A通过盛有100mL浓硫酸(足量)的洗气瓶,由洗气瓶导出的气体再通过装有足量Na2O2的干燥管,从干燥管导出的气体体积为3.36L(标准状况);
③取洗气瓶中溶液的1/10,与足量浓NaOH溶液混合并加热,产生的气体经干燥后测得体积为0.896L(标准状况)。
试根据上述实验结果,分析、计算、推断,
(1)样品的成分是什么?
(2)求样品中含氮的质量分数。
[当堂反馈]
4.化合价规则及其应用
(1)规则:不论在离子化合物里还是共价化合物里,化合价都有正价和负价,而且正、负化合价的代数和都等于零。也就是正价总数等于负价总数。在阴、阳离子中,各元素化合价等于该离子所带电荷数。
(2)应用:化合价反映了形成物质的不同元素的原子间的个数关系,它与化学式之间有着密切的内在联系。联系的桥梁就是化合物分子里各元素正、负化合价的代数和等于零这一原则。这个原则是应用化合价写出物质化学式的准则;是通过化学式计算化合价从而判断某元素的准则;是检查或判断物质化学式正误的准则。
3.化合价的实质
(1)在离子化合物里,元素化合价的数值,就是这种元素的一个原子得失电子的数目。失去电子的原子带正电荷,这种元素的化合价就是正价,且一个原子失去几个电子就是几价;得到电子的原子带负电荷,这种元素的化合价就是负价,且一个原子得几个电子就是负几价。
(2)在共价化合物里,元素化合价的数值,就是这种元素的一个原子跟其他元素的原子所形成的共用电子对的数目。共用电子对偏离哪种元素的原子,哪种元素就为正价;共用电子对偏向哪种元素的原子,哪种元素就显负价。
(3)由于化合价是元素的原子形成化合物时体现出的一种性质,因此单质的化合价为零。
2.阿伏加德罗定律
(1)内容:在相同温度、压强下,相同体积的任何气体都具有相同数目的分子。
(2)推论:
|
条件 |
结论 |
语言表达 |
|
T、P相同 |
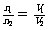 |
同温同压下,气体的分子数与其体积成正比 |
|
T、V相同 |
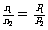 |
温度、体积相同的气体,压强与其分子数成正比 |
|
n、p相同 |
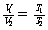 |
分子数相等、压强相同的气体,体积与其温度成正比 |
|
n、T相同 |
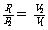 |
分子数相等、温度相同的气体,压强与其体积成反比 |
|
T、P相同 |
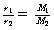 |
同温同压下,气体的密度与其相对分子质量(摩尔质量,下同)成正比 |
|
T、P、V相同 |
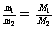 |
同温同压下,相同体积的气体,质量与其相对分子质量成正比 |
|
T、P、m相同 |
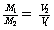 |
同温同压下,等质量的气体,相对分子质量与其体积成反比。 |
1.质量守恒定律
(1)定义:参加反应的各物质总质量等于反应后生成物各物质的总质量。
(2)原因:化学反应是原子的重组过程,反应前后原子的种类和数量都不发生变化。故反应前后的质量不会变化。
(3)拓展:
①反应元素前后种类不会变化。②反应前后各元素原子的数量不发生变化。③反应前后各元素原子的物质的量不发生变化。
(4)应用:①配平方程式的依据;②计算;③推断物质组成。
12.(威海市调研)某化学兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质。
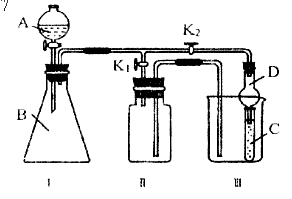
(1)能用Ⅰ装置制取,用Ⅱ装置收集的气体(K2关闭,K1打开)(写出一种即可)_____;有关化学反应方程式为:___________________________。
能用Ⅰ装置制取,不能有Ⅱ装置收集的气体(K2关闭,K1打开)(写出一种即可)
_________;若收集该气体,需对Ⅱ进行怎样的改进?__________________________。
(2)利用Ⅰ、Ⅲ装置验证物质的性质(K2打开,K1关闭)。
已知浓HCl与次氯酸钙能反应:Ca(ClO)2+4HCl(浓)==CaCl2+2Cl2↑+2H2O。甲同学想证明氧化性:Ca(ClO)2>Cl2>Br2,则在A中加浓盐酸,B中加Ca(ClO)2,C中加__________,观察到C中的现象是_____________________________________;
从环境保护的观点考虑,此装置有何不足?_______________________________________,应怎样改进?_____________________________________________________;
画出实验室中通常进行此操作的装置图:________________________。
乙同学利用此装置制取乙炔气体,将其通入C中验证性质。若C中装有酸性KMnO4溶液,其现象为_________________________;若C中装有溴水,则乙炔与溴水反应的产物为(写结构简式)__________________________________。
答案(1)H2或C2H2;方程式与气体要对应。H2S、CO2、NO、NO2等;改进方法;NO用排水法,其他要改为导管长进短出。
(2)NaBr溶液; 溶液由无色变成橙色或橙红色;氯气易逸出污染环境;应加NaOH溶液吸收氯气的装置
紫色褪去;CHBr2-CHBr2
10.(08山东潍坊高三教学质量检测)(10分)一般测定样品中成分含量的实验应重复2-3次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙、丙三位同学分别设计了如下实验方案:
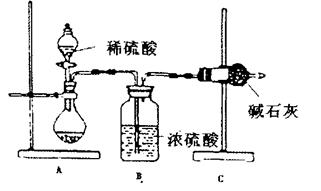
Ⅰ.甲同学的方案如上图所示:
(1)根据甲同学的实验装置图分析,在每次实验过程中所进行的称量操作至少要进行
次;
(2)甲同学重复测定了三次,得到碳酸钠的质量分数的数据存在较大的偏差,你认为可能的原因是 (填序号)。
A.装置内原有空气中的二氧代碳气体也被碱石灰吸收;
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收;
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收;
D.加入稀硫酸的量不足
 Ⅱ.乙同学的方案是:从下图所提供的装置中选择实验装置,代替甲同学实验的B、C,通过测定放出的二氧化碳的体积(不考虑二氧化碳溶于水)来计算。
Ⅱ.乙同学的方案是:从下图所提供的装置中选择实验装置,代替甲同学实验的B、C,通过测定放出的二氧化碳的体积(不考虑二氧化碳溶于水)来计算。
(1)选择最简装置的连接顺序为 ;
(2)产生的气体从装置⑤的 端进入。
Ⅲ.丙同学的方案是:称取样品mg,并溶解,加入过量氯化钡溶液,过滤、洗涤、烘干、称量,得固体ng。
(1)混合物中碳酸钠的质量分数为(用m、n表示) ;
(2)Ca2+、Ba2+都可以使CO32-沉淀完全。乙同学能否使用氯化钙溶液代替氯化钡溶液?
为什么? 。
答案Ⅰ.(1)4(1分)
(2)ABCD(2分)
Ⅱ.(1)⑤⑦⑥(2分)
(2)d(1分)
Ⅲ.(1)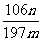 (2分)
(2分)
(2)不能,因为过量的Ca2+可能与OH-生成微溶于水的Ca(OH)2沉淀而影响测定结果(3分)
9.(08山东潍坊高三教学质量检测)(6分)某同学取一张铝箔,并用针刺一些小孔,然后取一药匙过氧化钠粉末,用铝箔包好,放入下图所示装置倒扣的漏斗中。
 (1)按顺序写出该过程中发生反应的离子方程式:
(1)按顺序写出该过程中发生反应的离子方程式:
①
② ;
(2)反应结束后,用拇指堵住试管口后将试管移出,
靠近燃着的酒精灯,松开手指,观察到的现象
是 。
答案 (1)①2Na2O2+2H2O 4Na++4OH-+O2↑
②2A1+2OH-+6H2O 2[A1(OH)4]-+3H2↑
(2)听到尖锐的暴鸣声(每空2分,共6分)
8.(08山东潍坊高三教学质量检测)(12分)氯及其化合物是中学化学中的重要研究对象。
(1)写出实验室中制取氯气的离子方程式 ;
(2)实验室也可以利用如下反应制取氯气:KC1O3+6HC1(浓) KC1+3C12↑+3H2O。若制取标准状况下的6.72L氯气,该反应中电子转移的物质的量为
;
(3)某同学用排空气法收集一瓶氯气,进行氯气与铁反应的实验:取一根细铁丝 ,然后立即伸入充满氯气的集气瓶中,观察到的现象是
。为观察生成的氯化铁溶液的颜色,向反应后的集气瓶中加入少量的蒸馏水,振荡,实际观察到的现象是 ,产生这种现象的原因是
;为真正观察到氯化铁溶液的颜色,应向反应后的集气瓶中改加(填试剂名称) 。
|
(1)MnO2+4H++2C1- Mn2++C12↑+2H2O(2分)
(2)0.5mol(2分)
(3)用砂纸将铁丝擦至光亮,用坩锅钳夹住,在酒精灯上烧至红热(2分);铁丝保持红热,产生棕褐色的烟(2分);产生红褐色的沉淀(1分);氯化铁发生水解,生成氢氧化铁沉淀(2分);稀盐酸溶液(1分)
7.(08山东省威海市模拟)(15分)某校科技活动小组用镁粉、
盐酸、醋酸设计以下实验,对两种
酸分别与镁反应的速率和电离平衡
理论进行研究,设计的实验装置如
图所示(夹持固定装置已略去)。
正确操作,记录得到下表中部分实验数据。
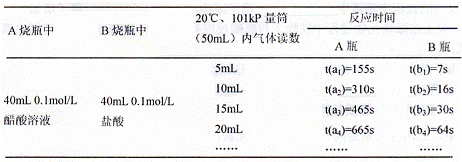
分析数据,观察实验装置图,回答下列问题:
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于 经小组研究后,稍作改进就可继续实验了;
(2)改进装置后,如何检查一侧装置的气密性?
方法是: ;
(3)欲配进100mL实验所需浓度的盐酸,除烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是 ;
(4)在实验数据中
①t(a1)远远大于t(b1)的原因为: ;
②由 [用含t(b1)、t(b2)、t(b3)代数式表示]说明盐酸是强酸不存在电离平衡;由 [用含t(b1)、t(b2)、t(b3)代数式表示]说明醋酸中存在电离平衡。
(5)该实验得到什么结论?(回答出两点即可)
①
②
(6)通过实验判断,锌与稀盐酸制氢气时,若要减慢反应速率而不影响产生氨气的量,可以加入 (填写两种不同作用原理的物质)。
答案 (1)量筒口胶塞的使用,使得反应产生的H2无法进入量筒(当反应开始之后,会造成烧瓶或量筒的胶塞被气体强力推出而发生危险)。
(2)将导管口放入水槽中,用手捂住烧瓶,如果导管口有气泡产生,松开手后导管内有一段水柱,证明装置不漏气。
(3)容量瓶(100mL);玻璃棒
(4)①开始阶段醋酸溶液中的[H+]远小于相同浓度的盐酸中的[H+]
②t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
(其它表示形式只要正确均给分)
(5)相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大(过一段时间,醋酸与镁反应速率较盐酸的快)。
盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
(6)CH3COONa固体、水或NaCl溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com