
1.
BD 2. A 3.AC 4. C 5. D 6. BC 7. B 8. B 9. D 10.C 讲析:在阴极生成a摩氢气,消耗的H2O也为a摩,被电解的H2O与w克Na2SO4·10H2O晶体中的“H2O”刚好可将w克Na2SO4·10H2O晶体中的“Na2SO4”溶解并形成饱和溶液: H2O的质量=18a+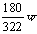 克 Na2SO4的质量=
克 Na2SO4的质量=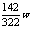 克
所以, 剩余溶液的质量分数
克
所以, 剩余溶液的质量分数
= =
=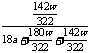 ×100%
×100%
0.1mol 0.1mol 0.2mol 0.1mol 0.4mol
0.1mol 0.2mol 0.1mol 0.4mol
故V(气体)=V(Cl2)十V(O2)=2.24L十2.24L=4.48L。
电解后c(H+)≈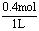 =0.4mol/L,
=0.4mol/L,
pH=-lg c(H+)=1-2lg2。
新活题网站
4.惰性电极时,依据阴、阳离子放电顺序书写电极反应,阳极:先2C1--2e=Cl2↑,后4OH--4e=O2↑+2H2O。在阳极附近,因OH-放电而促进了水的电离平衡右移,溶液酸性明显增强。由电子守恒关系:
C12 - Cu,另析出0.2mol Cu,2Cu - O2 - 4H+。
3.B 讲析:电解饱和的氯化钠溶液的化学方程式:
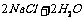
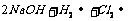 ,为使Cl2被完全吸收,制得较强杀菌能力的消毒液,与电源b极相连的电极应为阳极,产生氯气,与溶液充分反应,反应式为:
,为使Cl2被完全吸收,制得较强杀菌能力的消毒液,与电源b极相连的电极应为阳极,产生氯气,与溶液充分反应,反应式为:
Cl2+2NaOH=NaClO+NaCl+H2O
2.(1)正 (2)2NaCl+2H2O=H2↑+Cl2↑+2NaOH
(3)Zn-2e = Zn2+, Zn2++2e = Zn,ZnSO4溶液或ZnCl2溶液
1. D 讲析:电解H2SO4、Na2SO4、NaOH溶液都是电解水,溶质的浓度应相应的变化
18.由A、D、E、G四种常见元素组成的化合物的化学式AxDy(E2G4)z。已知:
①x、y、z均为正整数,且x+y+z=7
②取8.74g该化合物溶于水,加入强酸和强氧化剂。化合物中的E、G元素完全转化为气体化合物EG22.688L(标准状况),其密度为1.965g/L,EG2能使澄清石灰水变浑浊。
③发生上述反应后,A、D以阳离子存在于溶液中。往溶液里加入过量的铁粉,其中使D离子全部还原所消耗的铁粉的质量为0.560g。
④化合物中D元素的质量分数为12.81%。
试通过计算和推理确定该化合物的化学式。
17.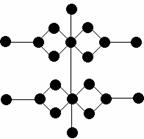 某一含结晶水的有机羧酸的铜盐,由化学分析知其最简式为C4H8O5Cu,通过对该晶体的结构分析,测得立体构型如右图(每个黑点表示一个原子,但不包括氢原子),
某一含结晶水的有机羧酸的铜盐,由化学分析知其最简式为C4H8O5Cu,通过对该晶体的结构分析,测得立体构型如右图(每个黑点表示一个原子,但不包括氢原子),
则此化合物的化学式是_________,结构简式为___________。
16.常温下,A和B两种气体混合而成的混合气体(A的相对分子质量大于B的相对分子质量),经分析知只含有碳和氧两种元素,而且无论A和B的分子个数以何种比例混合,氧元素和碳元素的质量比总大于8:3,由此确定A(化学式)_______,B(化学式)_______。若上述混合气体中,氧、碳质量之比为8:1,则在混合气体中A和B的分子个数之比是_________。
15.现有某纯净气体A,取标准状况下体积均为2.24L的两份样品,一份与过量的O2混合,燃烧后无固体物质生成,气体生成物均被过量的澄清石灰水吸收,得到13.90g沉淀。另一份在标准状况下与一定质量的SO2气体混合,测得混合气体对H2的相对密度为20。试推测A是什么?并写出A完全燃烧反应方程式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com