
3.据报道,我国拥有完全自主产权的氢氧燃料电池车在北京奥运会期间为运动员提供服务.某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是 ( )
A.正极反应式为:O2+2H2O+4e-===4OH-
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2===2H2O
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
解析:H2失去电子,在负极上被氧化,产生H+,由于电解液中有大量的OH-,所以电极反应式为:2H2-4e-+4OH-===4H2O.总反应式为:2H2+O2===2H2O,则正极反应式为:O2+2H2O+4e-===4OH-.工作一段时间后,KOH溶液被稀释,但KOH的物质的量不变.对D项,n(Cl2)=0.1 mol,转移电子0.2 mol.
答案:D
2.将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量的CuSO4溶液,如各图中产生H2的体积V(L)与时间t(min)的关系,正确的是 ( )
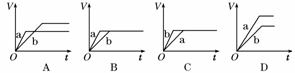
解析:若向a中加入少量的CuSO4溶液,则发生反应:Zn+CuSO4===Cu+ZnSO4,消耗一部分Zn,生成的Cu附着于Zn上,构成无数微小的Cu-Zn原电池,加快了Zn的反应速率,所以Zn与稀硫酸反应时,加入CuSO4溶液则反应速率加快,生成H2的量a小于b.
答案:A
1.如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验
后,在读书卡上的记录如下,则卡片上的描述合理的是 ( )
|
卡片号:2 2008.3.15,实验后的记录: ①Cu为负极,Zn为正极 ②Cu极上有气泡产生 ③ 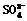 向Cu极移动 向Cu极移动④若有0.5mol电子流经导线,则可产生0.25mol气体 ⑤电子的流向是:Cu―→Zn ⑥正极反应式:Cu+2e-===Cu2+ |
A.①②③ B.②④
C.④⑤⑥ D.③④⑤
解析:①中Cu为正极,Zn为负极,③中SO向负极移动,⑤中电子的流向是:Zn―→Cu,⑥中正极反应式:2H++2e-===H2↑,故①③⑤⑥错.
答案:B
20、2009年10月7日,高三二班王卓同学因事一天不能上课,请你替他向班主任老师拟写一份请假条。(3分)
19、根据下面一幅对联的上联,对出下联,并似出恰当的横批。(4分)
上联:华夏儿女文武双全建伟业
下联:
横批:
(1)连峰去天不盈尺, 。
(2)剑阁峥嵘而崔嵬, , 。
(3)丛菊两开他日泪, 。
(4)无边落木萧萧下, 。
(5)别有幽愁暗恨生, 。
(6)东船西舫悄无言, 。
(7)同是天涯沦落人, 。
(8) ,往往取酒还独倾。
(9) ,蓝田日暖玉生烟。
(10) ,申之以孝悌之义。
(11) ,涂有饿莩而不知发。
(12) ,不如须臾之所学也。
(13) ,则知明而行无过矣。
(14) ,信臣精卒陈利兵而谁何。
(15) ,氓隶之人,而迁徙之徒也。
(16) ,比权量力,则不可同年而语矣。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com