
9.(08山东一模)下列除去杂质的方法正确的是 ( D )
|
|
物
质 (杂 质) |
除 杂 方 法 |
|
A |
Cl2(HCl) |
将气体通过盛有氢氧化钠溶液的洗气瓶 |
|
B |
C2H4(SO2) |
将气体通过盛有高锰酸钾溶液的洗气瓶 |
|
C |
氢氧化铁胶体(FeCl3) |
将混合物直接过滤 |
|
D |
SiO2 (CaCO3) |
加入盐酸后过滤 |
8.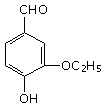 (08山东一模)乙基香草醛是食品添加剂的增香原料,其结构简式如右图所示,下列对该物质叙述正确的是: ( D )
(08山东一模)乙基香草醛是食品添加剂的增香原料,其结构简式如右图所示,下列对该物质叙述正确的是: ( D )
A.该物质可以进行消去反应
B.该物质可以进行水解反应
C.1mol该物质最多可与3 mol H2反应
D.该物质可以和Br2进行取代反应
7.(08山东德州模拟)下列叙述中正确的是 ( D )
A.单质分子中一定存在共价键
B.共价化合物中不一定存在共价键
C.除去乙烷中少量的乙烯可在光照条件下通入Cl2,然后进行气液分离
D.苯、乙醇和乙酸都能发生取代反应
6.(08山东德州模拟)糖类、油脂、蛋白质为动物性和植物性食物中的基本营养物质。下列有关说法正确的是( D )
A.蛋白质中只C、H、O三种元素
B.油脂在人体中发生水解的产物是氨基酸
C.糖类的主要成分是高级脂肪酸甘油酯
D.糖类、油脂、蛋白质都可能发生水解反应
4.(08山东济宁4月模拟)下列说法中,不正确的是( A )
A.形成化学键吸收能量,破坏化学键释放能量
B.14g乙烯和丙烯的混合物中原子的物质的量为3 mol
C.向豆浆中加入硫酸钙溶液会产生聚沉现象
D.H+、NO3-、Fe2+、Na+在溶液中不能大量共存
2.(08山东高考冲刺预测卷)2007年12月4日浙江省卫生厅公布的最常见的四种疾病中,高血压排在第一位,胆结石排在第二位,可见在全民社会中普及如何预防胆结石显得尤为重要。从化学上讲,非结合胆红素(VCB)分子有羟基,被氧化后(生成羧基)与钙离子结合形成胆红素钙的反应,就是一个生成沉淀的离子反应,从动态平衡的角度分析能预防胆结石的方法是( )
A.大量食用纯碱可使钙离子沉淀完全,预防胆结石产生
B.不食用含钙的食品
C.适量服用维生素E、维生素C等抗氧化自由基可预防胆结石
D.手术切除胆囊
答案:C
解析:A使钙离子沉淀完全,B不食用含钙的食品,这样易引起人体缺钙。D切除胆囊不可取,C服用维生素可预防羟基氧化生成羧基。
|
|
A.丙烷既能发生取代反应,又能发生加成反应
B.丙烷完全燃烧,其产物对空气没有污染
C.丙烷燃料电池中,丙烷在正极发生反应
D.丙烷的一氯取代物有三种同分异构体
13.{江苏省赣榆高级中学09高三年级十二月 }(8分)氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s) + H2O(g) 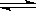 H2(g) + CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
H2(g) + CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
该反应在低温下能否自发 (填:能或否)。
(2)已知在400℃时,N2
(g)+ 3H2(g) 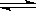 2NH3(g) △H<0 的K=0.5,
2NH3(g) △H<0 的K=0.5,
①2NH3(g)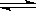 N2 (g)+ 3H2(g)的K=
(填数值)。
N2 (g)+ 3H2(g)的K=
(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)
(3)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2
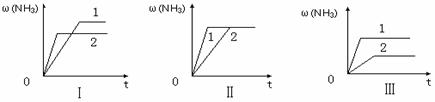
答案..(1)否(不能) (2)2, = (3)D
12.(江苏海门市2008-2009学年高三第一次教学质量调研)(12分)加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
[问题1]工业生产碘酸钾的流程如下:
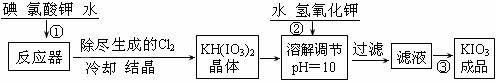
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式:_________________________________;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是____________。
|
温度/℃ |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
8.08 |
12.6 |
18.3 |
24.8 |
[问题2]已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;
I2+2S2O32―=2I-+S4O62-。
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘时,用到的主要玻璃仪器有 。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全。则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(3)学生丙又进行了下列实验:
|
操作步骤 |
实验现象 |
|
取1g纯净的NaCl,加3mL水配成溶液。 |
溶液无变化 |
|
滴入5滴淀粉溶液和1mL
0.1mol/L KI溶液,振荡。 |
溶液无变化 |
|
然后再滴入1滴1mol/L的H2SO4,振荡。 |
溶液变蓝色 |
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: 。
答案.[问题1](1)6I2 + 11KClO3 + 3H2O = 6KH(IO3)2 + 5KCl + 3Cl2↑;(2)蒸发结晶;
[问题2](1)分液漏斗(多写烧杯、玻璃棒等合理答案不扣分);(2)1270/3w(423.33/w)。
(3)①4I-+4H++O2=2I2+2H2O;②学生乙的实验结果会偏大。
11.(江苏海门市2008-2009学年高三第一次教学质量调研)(12分)海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法。你认为蒸馏法海水淡化最理想的能源是 ;
(2)从海水中可得到多种化工原料和产品。下列是利用海水资源的流程图。
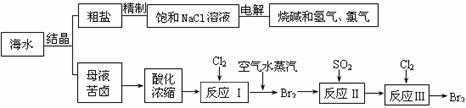
① 反应II的离子方程式为 ;
从反应III后的溶液中得到纯净的单质溴的实验操作方法是 。
② 在母液苦卤中含有较多的NaCl、MgCl2、KCl、MgSO4等物质。用沉淀法测定苦卤中Mg元素的含量(g/L),实验过程中应测定的数据有 ;
③ 电解25%的饱和食盐水200kg,当NaCl浓度下降到20%时,计算收集到氯气的物质的量。(溶于溶液的氯气忽略不计,计算结果保留一位小数)
答案.(12分)(⑴⑵两题每空2分) ⑴太阳能等;
⑵ ① SO2+Br2+2H2O=4H++2Br-+SO42-; 蒸馏(多写萃取不扣分);
② 苦卤样品的体积、Mg(OH)2沉淀的质量;
③ 97.7 mol。 (此小题4分,根据计算过程,酌情给分。)
说明:本试卷中其他合理答案同样给分
10.(江苏海州高级中学2009届高三化学第三次综合测试)(12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O NH4HCO3 ; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号);
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
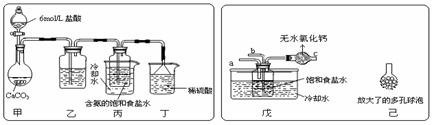 ① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
 (Ⅰ)乙装置中的试剂是
;
(Ⅰ)乙装置中的试剂是
;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从a管通入 气体,再从b管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
答案..(1)c (2)①(Ⅰ)饱和碳酸氢钠溶液;(Ⅱ)吸收未反应的NH3(答“防止倒吸”或“吸收CO2”不给分);(Ⅲ)过滤 ②(Ⅰ)NH3,CO2 ;(Ⅱ)增大气体与溶液接触面积,提高CO2吸收率;
(3)用碳酸氢铵与适量饱和食盐水反应。(或往烧碱溶液中通入过量CO2 ;往饱和Na2CO3 溶液中通入过量CO2 等.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com