
2.已知常温时反应2Fe3++Cu==2Fe2++Cu2+在水溶液中能发生,将22.4 g由铜和三氧化二铁组成的混合物粉末加入到浓度为1 mol·L-1的硫酸中,使之发生反应。
(1)若固体恰好全部溶解,消耗硫酸的体积为V,则V的取值范围为_________。
(2)若硫酸溶液过量,反应后溶液的体积为1 L,测得溶液中Fe2+浓度为0.1 mol·L-1,则原始混合物中含铜的质量为_________。
1.将2 w g某铁、铝混合粉末平均分为两份,一份与足量盐酸反应,生成气体的体积为V1;另一份与足量NaOH溶液反应,生成气体的体积为V2(气体体积均在标准状况下测定)。
(1)若w=13.9,V1与V2之和为11.2 L,混合物中铁和铝的物质的量之比为多少?
(2)若铁、铝按不同的比例混合进行上述实验时,所生成的气体总体积仍为11.2 L,则w的取值范围是 。
4.过量计算
(1)过量计算中过量判断判断的方法:①比例法:将反应物的已知量与化学方程式中的关系量相比,比值大者即为过量的反应物,然后根据不过量的那种反应物的量来计算。②极值法:常用于某混合物与一种物质反应,如一定质量碳酸钠和碳酸氢钠混合物与一定量盐酸反应,或一定体积甲烷、氢气、乙烷混合气与一定体积氧气反应,判断的方法为假设混合物为全为消耗另一反应物最多或最少的一种物质,看能否完全反应,判断出该反应物一定过量过一定不足,从而选择适当的物质进行计算。
(2)过量计算的几种类型:
①常规题型:若已知两个反应物的量,应先过量判断,再根据不足量进行计算。②多种反应物混合型:若反应物有三种或三种以上,过量判断时,需判断有哪两种或两种以上的物质过量。③反应物总量确定型:反应物未全部消耗(即肯定有物质过量),需讨论何者反应物过量。④反应物用量不确定型:在有些物质之间进行的化学反应,由于反应物相对用量不同而会导致产物不同, 往往借助数轴、极值法等来讨论。⑤金属与酸或碱反应(天平问题)的过量计算:“天平问题”一般涉及两种类型的计算:过量计算和差量计算。
[典型例析]
例1:2005年国家质检总局铝合金抽检合格率约为90%。已知国家行业标准中铸造铝合金的各成分的质量分数为:Si-4.5%-5.5%,Cu-1.0%-1.5%,Mg-0.4%-0.6%,其余为Al。现对某品牌的铸造铝合金中所含的四种成分作如下的实验检测:①称取18.0g铸造铝合金样品,分成等质量的A、B两份。向A份加入足量NaOH溶液,B份加入足量的稀盐酸。②待两份反应物都充分反应之后,称得滤渣质量相差0.512g,收集得到的两份气体的体积相差851.2mL(标准状况下)。试回答下列问题:
(1)样品中Si和Mg的物质的量分别是多少。
(2)通过计算判断该品牌的铸造铝合金是否为合格产品。
变式训练:
将一定质量的K2SO4、(NH4)2SO4、NH4HCO3 的固体混合物加入到100mL 0.5mol/L的Ba(OH)2溶液中,共热使之充分反应,NH3全部逸出,同时生成沉淀8.6g。在所得固液混合物中加100 mL 0.9 mol/L的盐酸,沉淀部分溶解,同时生成448 mL CO2 气体(标准状况)。剩余盐酸用50mL 0.2 mol/L的NaOH溶液恰好中和。求原混合物中各物质的物质的量。
例2:某天然碱(纯净物)可看做由CO2和NaOH反应后的产物所组成。称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液 30 mL,产生CO2体积(标准状况)如下表:
|
|
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
|
盐酸溶液的体积/mL |
30 |
30 |
30 |
30 |
|
样品的质量/g |
3.32 |
4.15 |
5.81 |
7.47 |
|
二氧化碳的体积/mL |
672 |
840 |
896 |
672 |
(1)由第Ⅰ组数据中的CO2体积与样品质量之比,可以推测用2.49 g样品进行同样的实验时,产生CO2
mL(标准状况)。
(2)另取3.32 g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2 112 mL(标准状况)和水0.45 g,计算并确定该天然碱的化学式。
(3)已知Na2CO3和HCl(aq)的反应分下列两步进行:
Na2CO3+HCl==NaCl+NaHCO3,NaHCO3+HCl==NaCl+CO2↑+H2O,由上表中第Ⅳ组数据可以确定所用的HCl(aq)的浓度为 mol·L-1。
(4)依据上表所列数据以及天然碱的化学式,讨论并确定上述实验中CO2(标准状况)体积V(mL)与样品质量W(g)之间的关系式。
变式训练:
实验证明,C还原CuO时既可能生成Cu,也可能生成Cu2O,即使在C过量时,实验中CuO也可能部分未被还原。为了测定某次实验产物的组成,取1.2 g C跟8.0 g CuO混合,加热后将反应生成的气体通过足量的澄清石灰水。一段时间后停止加热,共收集到560 mL气体(已经折算成标准状况),测得沉淀的质量为2.5 g。则:
(1)上述实验中C (填“完全”或“不完全”)参加反应,实验中收集到的气体是______(填写化学式),产生这种气体的化学方程式为 。
(2)反应后得到的固体混合物总质量为 ,其中含氧化合物 的物质的量为 。
(3)被还原生成Cu2O的CuO占总CuO的物质的量分数为x,试通过 计算求出反应中生成Cu的质量[m(Cu)]与x的关系。
(4)请在右图中画出m随x变化的图像。

[当堂反馈]
3.多步反应的计算:多步反应指某一种初始原料经若干步反应后才得到最终产物。多步反应的计算,可以根据各步反应的化学方程式从前向后或从后向前,一步一步进行计算求解,但这种方法计算繁琐,容易出错。因此,涉及多步反应的计算,我们一般根据发生反应的化学反应方程式,找出最初反应物和最终生成物之间物质的量的关系,称为“关系式”。寻找关系式的方法很多,如:元素守恒法、电子守恒法、方程式叠加法等。例如,在硫酸的工业生产中,原料FeS2与产物H2SO4之间的关系式为FeS2 - 2H2SO4。再如,氨催化氧化制硝酸生产中,由于NO的循环使用,从元素(N元素或N原子)守恒可得关系式为NH3 - HNO3。
2.平行反应的计算:平行反应一般是两个反应共用了至少一种相同的反应物,其解题方法一般是将两平行反应按一定比例叠加成一个总反应。如H2S和O2一定比例混合燃烧时能发生下列两个反应:
2H2S+O2=2S+2H2O 2H2S+3O2=2SO2+2H2O
设两个反应中H2S的物质的量之比为1∶a ,则将两个反应合并为:
(2+2a) H2S + (1+2a)O2=2S + 2aSO2 + (2+2a)H2O
其中(2+2a)∶(1+2a)即为参加反应的H2S和O2的物质的量之比或体积比。
平行反应也可以用两种反应物的总量之和列出二元一次方程组求解。
1.独立反应的计算:独立反应是指发生一个化学反应或多个相互间没有必然联系的化学反应,这是最简单的化学计算,计算时一定要注意方程式中同一化学式下的物理量要上下一致,不同物质之间要左右成比例。
1.(08枣庄三诊)[化学-有机化学基础]
2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾

功能衰竭。“亮菌甲素”的结构简式为 ,它配以辅料丙二
|
醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强
的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为 。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其属于醇类的同分异构体的结构简式 。
(3)下列有关“亮菌甲素”的叙述正确的是 (填序号)。
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4退色
C.“亮菌甲素”分子中含氧官能团只有2种
D.1mol“亮菌甲素”最多与2molNaOH反应
(4)核磁共振仪可以测定有机物分子中处于不同化学环境的氢原子及相对数量。氢原子在分子中的化学环境不同,在核磁谱图中就处于不同的位置,化学环境相同的氢原子越多,波谱峰积分面积越大(或高度越高)。核磁共振氢谱分析,发现二甘醇分子中有3个肿收峰,其峰面积之比为2:2:1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1mol二甘醇与足量的金属钠反应生成1molH2。写出二甘醇与乙酸(按物质的量之比1:1)反应的化学方程式
。
答案[化学-有机化学基础]
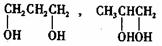 (1)C12H10O5
(1)C12H10O5
(2)
 (3)A
(3)A
(4)HOCH2CH2OCH2CH2OH + CH3COOH CH3COOCH2CH2OCH2CH2OH + H2O
(每小题2分)
 2.(08山东高考冲刺预测卷)(8分)[化学-有机化学基础]
2.(08山东高考冲刺预测卷)(8分)[化学-有机化学基础]
有机物A的结构简式为
,它可通过不同化学反应分别制得B、C、
 D和E四种物质。
D和E四种物质。
请回答下列问题:
(1)指出反应的类型:A→C: 。
(2)在A~E五种物质中,互为同分异构体的是 (填代号)。
(3)写出由A生成B的化学方程式
。
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填序号)。
(5)C能形成高聚物,该高聚物的结构简式为 。
(6)写出D与NaOH溶液共热反应的化学方程式
。
1.(08枣庄第一次调研)丙烯醇(CH2=CH-CH2OH)可发生的化学反应有 ( )
①加成 ②氧化 ③酯化 ④加聚 ⑤取代
A.只有①②③ B.只有①②③④ C.①②③④⑤ D.只有①③④
2(08山东高考冲刺预测卷).背景材料:①2007年10月25日,重庆南川区跃进煤矿发生瓦斯爆炸事故。②2007年9月2日,山东金岭集团发生液氯泄漏事故,集团内部职工以及该公司北侧的金宇轮胎厂部分职工数百人氯气中毒。③2007年10月24日,“嫦娥一号”发射升空。④2007年11月5日来自国家地质实验测试中心的数据显示,在检测分析的甲醛、苯、甲苯、二甲苯和TVOC五项车内有害元素中,50款车型中有42款存在不同检测项超标问题,超标率达到82%。其中,甲醛的超标现象最为严重,93%的被测新车车内空气中所含的甲醛含量都超过室内甲醛国际限量值。据此判断,下列说法正确的是( )
A.为降低甲醛含量,新车应紧闭门窗,并放置加湿器
B.发生“液氯泄漏”时,应疏导群众就近向地下室或地下建筑物转移
C.“瓦斯”爆炸最猛烈时,煤矿坑道中甲烷的体积分数为33.3%
D.有朝一日宇航员乘坐“嫦娥”遨游月空时,在其轨道舱中无法完成“粗盐的提纯”实验
答案:D
解析:甲醛易挥发,可以敞开门窗,通风。因为氯气密度比空气大,所以氯气泄漏时应该将人员转移至高处。“瓦斯”爆炸最猛烈时,应是甲烷与氧气恰好完全反应时,根据化学反应方程式CH4+2O2=CO2+2H2O可知此时甲烷的体积分数应该是9.1%左右。“粗盐的提纯”实验需依靠重力作用,轨道舱中失重状态下无法“粗盐的提纯”实验。
 3(08山东二模).在体育比赛中使用兴奋剂是一种不符合奥林匹克精神的行为,某种兴奋剂的结构简式如右图所示,有关该物质的说法中正确的是
3(08山东二模).在体育比赛中使用兴奋剂是一种不符合奥林匹克精神的行为,某种兴奋剂的结构简式如右图所示,有关该物质的说法中正确的是
A.分子内所有原子在同一平面上
B.因为该物质是苯酚的同系物所以遇FeCl3溶液可呈现紫色
C.1mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4mol和7mol
D.若能使酸性KMnO4溶液的紫色褪去,则可证明该物质分子中是否含有碳碳双键
15..(08山东省滨州市三检)为提纯下列物质(括号内为少量杂质),所选用的除杂式试剂和分离方法正确的是( C )
|
|
提纯物质 |
除杂试剂 |
分离法 |
|
A |
KCl溶液(FeCl3) |
氨水 |
过滤 |
|
B |
乙酸乙酯(乙酸) |
乙醇和浓梳酸 |
分液 |
|
C |
NaCl溶液(Na2S) |
AgCl |
过滤 |
|
D |
乙醇(H2O) |
金属钠 |
蒸馏 |
 1.(08山东德州模拟)(10分)有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图装置(夹持装置仪器已省略),其实验操作为:先按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。试回答以下问题:
1.(08山东德州模拟)(10分)有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图装置(夹持装置仪器已省略),其实验操作为:先按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。试回答以下问题:
(1)A中发生反应的化学方程式: ,B的作用: ;C中热水的作用: 。
(2)M处发生的反应的化学方程式为:
(3)从M管中可观察到的现象: 从中可认识到该实验过程中催化剂 (填“参加”或“不参加”)了化学反应,还可以认识到催化剂起催化作用需要一定的 。
(4)实验一段时间后,如果撤掉酒精灯,反应 (填“能”或“不能”)继续进行,其原因是: 。
(5)验证乙醇氧化产物的化学方法是
。
 答案.(10分),每空1分)
答案.(10分),每空1分)
(1)2H2O2 2H2O+O2;
B的作用干燥O2;C中热水,使D中乙醇变为蒸气进入M中参加反应

 (2)2CH3CH2OH+O2 2CH3CHO+2H2O或(2Cu+O2 2CuO
(2)2CH3CH2OH+O2 2CH3CHO+2H2O或(2Cu+O2 2CuO
 CH3CHOH+CuO CH3CHO+Cu+H2O)
CH3CHOH+CuO CH3CHO+Cu+H2O)
(3)受热部分的铜丝由于间歇性地鼓入空气而交替出现变黑,变红的现象;参加;温度
(4)能;乙醇的催化氧化反应是放热反应,反应放出的热量维持反应继续进行。
(5)实验结束后,卸下装置B中盛有少量蒸馏水的水试管,从中取出少许溶液做银镜反应的实验(也可使之与新制Cu(OH)2溶液反应),来证明乙醛的生成。
08山东高三模拟化学试题汇编-有机基础
14.(08山东省滨州市三检)下列表达正确的是 ( C )
A.常温下,pH=1的水溶液中Na+、NO-3、HCO3、Fe2+可以大量共存
B.乙烯、苯和乙醇都不能发生加成反应和加聚反应
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O
D.醋酸与氢氧化钠溶液反应后,溶液显碱性,则溶液中各离子浓度一定存在如下关系
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com