
7.有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO)
A.0.448L B.0.672 C.0.896 D.0.224
6.不溶于水的Cu2O,可溶于含H2SO4的Fe2(SO4)3溶液中,其化学方程式为:
Cu2O+Fe2(SO4)3+H2SO4=2CuSO4+2FeSO4+H2O此时生成的FeSO4可用KMnO4的H2SO4溶液滴定,还原产物为MnSO4,通过这样的方法可测定Cu2O的含量,则每消耗0.1mol·L-1KMnO4的H2SO4溶液1mL,相当于含Cu2O
A. 3.6 ×10-2g B.7.2 ×10-3g
C.3.5 ×10-2g D.3.6 ×10-3
5.N2、H2 混合气体(体积之比为 1∶3)通入合成塔中,此时塔内压强为 3.0×107 Pa 时,反应达平衡时,压强降为 2.5×107 Pa,则平衡时混合气体中 NH3 的体积分数为
A.35% B.30% C.1/4 D.1/5
4.等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5︰6,则甲、乙两烧杯中的反应情况可能分别是
A.甲、乙中都是铝过量
B.甲中铝过量、乙中碱过量
C.甲中酸过量、乙中铝过量
D.甲中酸过量、乙中碱过量
3.现向 1.06 g 含杂质的碳酸钠样品中加入过量的氯化氢溶液,得到标准状况下干燥纯净的气体 2.20 L,则该碳酸钠样品中所含杂质可能是
A.碳酸钡和碳酸钾 B.碳酸钾和碳酸氢钠
C.碳酸氢钠和碳酸氢钾 D.碳酸钙和碳酸锌
2.在密闭容器中,放入(NH4)2CO3 和 NaOH 的固体混合物共 19.6 g,将容器加热到 250℃,充分反应后,排出容器中的气体,冷却称得剩余固体质量为 12.6 g。则原混合物中(NH4)2CO3 和 NaOH 的物质的量之比为
A.>1∶2 B.= 1∶2
C.<1∶2 D.以上答案都不正确
1.用 H2 还原 x g CuO,当大部分固体变红时停止加热,冷却后得残留固体yg,共用掉z g H2,此时生成水的质量为
A.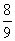 (x-y) g B.
(x-y) g B.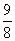 (x -
y) g
(x -
y) g
C.9 z g D.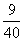 z g
z g
5.某化工厂以甲烷为原料合成甲醇的反应为:
CH4(g)+H2O(g)→CO(g)+3H2(g) ……①(反应中CH4转化率:1)
CO(g)+2H2(g)→CH3OH(g) ……②(反应中CO转化率:2/3)
合成工艺如下(虚线框内为改进后的工艺中新增流程):
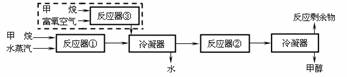
请回答下列问题(所有气体体积均折算为标准状况):
(1)原工艺中,当充入反应器①的甲烷和水蒸汽的体积分别为672m3和1750m3时,反应剩余物中n(CO)= ,n(H2)= 。
(2)为充分利用反应剩余物,该厂在原工艺的基础上,将下列反应运用于生产甲醇原料气:2CH4(g)+O2(g)→2CO(g)+4H2(g) ……③(反应中CH4转化率:1),若新工艺中充入反应器①的甲烷和水蒸汽的体积分别为a、3a,反应剩余物中:V(H2)∶V(N2)∶V(CO)=3∶1∶1。计算:
①充入反应器③的甲烷的体积;
②若富氧空气中除O2、N2外,其他成分忽略不计,则充入反应器③中的富氧空气的体积为 ;应选择氧气体积分数为 的富氧空气。
[课后巩固]
4.已知M(Mg)=24 g·mol-1,Vm=22.4 L·mol-1,今有0.48 g金属镁与10 mL盐酸反应,计算生成的H2在标准状况下的体积V(H2)。
(1)缺少的一个数据a是_______(要求指出该数据的名称、符号和单位)。
(2)写出计算式:
①_________________;②__________________。
3.用黄铁矿可以制取 H2SO4,再用 H2SO4 可以制取化肥(NH4)2SO4。煅烧含 FeS2 80.2% 的黄铁矿 75.0 t,最终生产出 79.2 t(NH4)2SO4。已知 NH3 的利用率为 92.6%,H2SO4 的利用率为 89.8%,试求黄铁矿制取 H2SO4 时的损失率。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com