
18.图为短周期的一部分,推断关于Y、Z、M的说法正确的是 ( )
A.非金属性:Y>Z>M
B.原子半径:M>Z>Y
C.气态氢化物的稳定性:Y<M<Z
D.ZM2分子中各原子的最外层电子均满足8e-稳定结构
17.常温下,下列各组离子在给定条件下一定能大量共存的是 ( ) ( )
A.在pH=0的溶液中:I-、Ca2+、NO3-、NH4+
B.存在大量Fe2+的溶液:SCN-、Na+、NO3-、SO42-
C.在由水电离出的c(OH-)=10-13mol·L-1的溶液中:ClO-、Na+、SO32-、Cl-
 D.在c(OH-)=1.0ⅹ10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-
D.在c(OH-)=1.0ⅹ10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-
16.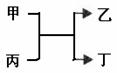 甲、乙为短周期同一主族元素组成的单质,丙、丁为含氧化合物,它们存在如下转化关系:满足条件的甲和乙分别为 ( ) ( )
甲、乙为短周期同一主族元素组成的单质,丙、丁为含氧化合物,它们存在如下转化关系:满足条件的甲和乙分别为 ( ) ( )
A.铝和铁 B.氯气和溴
C.铝和氢气 D.钠和氢气
15.下列对化学知识的总结,你认为合理的组合是 ( )
①能与酸反应的氧化物,一定是碱性氧化物
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
④在熔化状态或水溶液中能导电的物质称为电解质
⑤NF3的沸点比NH3的沸点低是因为N-F键比N-H键的键能大
⑥过氧化氢和液氮的分子中都有非极性共价键
A.只有③④ B.只有③⑥
C.只有⑤⑥ D.只有①②⑥
14.a g下列物质在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增重b g,符合b>a 的选项有 ( )
A.HCHO B.CH3COOCH2CH3
C.HOOCCOOH D.HCOOH
13.氮化钠和氢化钙都是离子化合物,与水反应的化学方程式(未配平)如下: Na3N+H2O →NaOH +NH3 ,CaH2+H2O →Ca(OH)2 +H2.有关它们的叙述:
①离子半径:Na+>N3->H+ ;②与水反应都是氧化还原反应;③与水反应后的溶液都显碱性;④与盐酸反应都只生成一种盐;⑤两种化合物中的阴阳离子均具有相同的电子层结构。其中正确的是 ( )
A.②③④⑤ B.①③⑤ C.②④ D.③
12.从下列事实所列出的相应结论正确的是 ( )
|
|
实 验 事 实 |
结 论 |
|
A |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
|
C |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
酸性:HCO3->Al(OH)3 |
|
D |
SO2通入KMnO4溶液,溶液褪色 |
SO2具有漂白性 |
11.用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.0.1molCnH2n+2中含有的C-C键数为0.1NA
B.6.9g钠与足量的CO2和H2O(g)混合气体充分反应,转移的电子数一定为0.3NA
C.0.1mol/L的氯化铝溶液中含有的氯离子数为0.3NA
D.标准状况下,2.24L氯仿中含有C-Cl键数为0.3NA
10.在配制一定物质的量浓度的盐酸时,下列操作可使所配溶液浓度偏高的是 ( )
A.用量筒量取浓盐酸时俯视读数 B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线 D.摇匀后见液面下降,再加水至刻度线
9.下列离子方程式中,不正确的是 ( )
A.用碳棒作电极电解硫酸铜溶液: 2Cu2+ + 2H2O = 2Cu + O2↑+ 4H+
B.在硫酸氢钾溶液中加入氢氧化钡溶液至中性 :
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:
2Al3++ 3SO42-+ 3Ba2+ + 6OH-=2Al(OH)3↓+ 3BaSO4↓
D.硫酸亚铁的酸性溶液中加入H2O2溶液: 2Fe2++H2O2+2H+=2 Fe3++2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com