
28.(10分)某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:
① 用蓝色石蕊试纸检测该溶液,试纸显红色; 。
② 取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色;
③ 取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④ 取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤ 取实验 ④ 后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
⑴用简要语言描述在实验 ① 中的操作
⑵根据上述实验判断原溶液中肯定存在的离子是______________,
肯定不存在的离子是
⑶写出与②③两个实验有关的离子方程式:
②___________________________ ③_________________________
27.(10分) 叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质。
(1)NaN3中存在的化学键有 (答案可能不止一个,填字母)。
a.离子键 b.极性共价键 c.非极性共价键
(2)3mol NaN3受撞击会生成4mol 氮气和一种离子化合物A,可用于汽车保护气囊。请写出有关反应的化学方程式 。
Ⅱ.已知X、Y、Z、W是短周期中的四种非金属元素,它们的原子序数依次增大。X元素原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
⑴仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子方程式为_ 。
⑵这四种元素可组成原子个数比为5:1:1:3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量的NaOH溶液反应的离子方程式为: 。
26.(10分)已知①A,B,C,D四种物质均含元素X,有的还可能含有元素Y,Z。元素Y,X,Z的原子序数依次递增。
②X在A,B,C,D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是____________,Z是_____________。
(2)写出③中反应的化学方程式: 。
(3)写出④中反应的化学方程式: 。
25.用石墨电极电解含有一定量重水(D2O)的水(H2O),下列说法正确的是 ( )
A.相同状况下两电极上产生的气体体积之比为2∶1
B.两电极上产生的气体质量之比为8∶1
C.相同状况下两电极上产生的气体体积之比为4∶1
D.若两电极上产生的气体质量比为16∶3,则D2O与H2O的物质的量之比为2∶1
Ⅱ卷(非选择题 共60分)
24.几种短周期元素的原子半径及某些化合价见下表,下列说法正确的是 ( )
|
元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
|
化合价 |
–1 |
–2 |
+4、–4 |
+7、–1 |
+5、–3 |
+3 |
+2 |
+1 |
|
原子半径/nm |
0.071 |
0.074 |
0.077 |
0.099 |
0.110 |
0.143 |
0.160 |
0.186 |
A.A的单质能将E单质从HE3的溶液中置换出来
B.A、H、J的离子半径由大到小顺序是A>J>H
C.G元素的单质不存在同素异形体
D.I在DB2中燃烧生成两种化合物
23.下列有关热化学方程式的叙述正确的是 ( )
A.已知2H2(g)+O2(g)= 2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
B.已知C(石墨,s)= C(金刚石,s);△H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH+HCl=NaCl+H2O;△H=-57.4 kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g) ;△H2。则△H1<△H2
22.下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的图象是
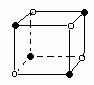
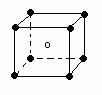
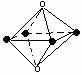
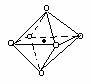
⑴ ⑵ ⑶ ⑷
A、图⑴和图⑶ B、图⑵和图⑶ C、图⑴和图⑷ D、只有图⑴
21.将Mg、Cu组成的混合物26.4g,投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol/L的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是: ( )
A.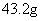 B.
B.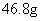 C.
C.
 D.
D.
20.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。

下列说法中不正确的是 ( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
19.将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+ 28HNO3=9Fe (NO3)x+ NO↑+14H2O 。下列判断合理的是 ( )
A.Fe (NO3)x中的x为2
B.反应中每生成0.2 mol 还原产物,就有0.6 mol 电子转移
C.稀HNO3 在反应中只作氧化剂 D.磁性氧化铁中的铁元素全部被氧化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com