
10.B解析:先加KSCN溶液若不变红,则可证明无Fe3+;再滴加氯水立即呈红色,则可证明原溶液中有Fe2+。Fe2+遇SCN-无明显变化,滴加氯水后,Fe2+被氧化生成Fe+,Fe3+与SCN-结合使溶液变红了,故B是正确的实验方法。
9.AB
解析:Fe+H2SO4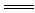 FeSO4+H2↑
FeSO4+H2↑
2FeCl3+Fe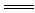 3FeCl2
3FeCl2
Fe+CuSO4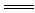 FeSO4+Cu
FeSO4+Cu
FeSO4溶液不能溶解Fe,故答案选A、B。
8.D解析:滴加少许KSCN溶液,无红色出现;再加少许氯水后若立即出现红色,则证明原溶液中一定存在Fe2+。
7.D解析:依题意,最后所得固体为Al2O3,其物质的量为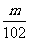 mol,故原
mol,故原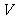 LAl2(SO4)3溶液中含SO
LAl2(SO4)3溶液中含SO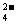 的物质的量为(
的物质的量为(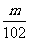 ×3)mol,
×3)mol,
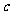 (SO
(SO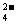 )=
)= =
=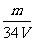 mol.L-1,所以答案选D。
mol.L-1,所以答案选D。
0.3×0.24×0.3×0.2
得2×0.2×0.2+4×0.3×0.2=4×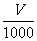 ,即
,即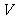 =80Ml。
=80Ml。
0.2×0.22×0.2×0.2
Al3+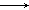 4OH-
4OH-
6.C解析:欲使Mg2+全部转化成沉淀并从溶液中分离出来,应向溶液中加入过量的NaOH溶液,使Mg2+、Al3+全部沉淀后,再使Al(OH)3恰好溶解。设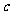 (Al3+)=
(Al3+)=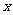 mol·L-1,则根据电荷守恒:
mol·L-1,则根据电荷守恒:
3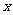 +2
+2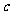 (Mg2+)
(Mg2+)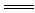
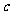 (Cl-),即3
(Cl-),即3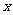 +2×0.2=1.3,
+2×0.2=1.3,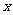 =0.3mol·L-1。
=0.3mol·L-1。
设NaOH溶液的体积为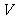 mL,
mL,
则根据关系式:Mg2+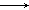 2OH-
2OH-
5.D解析:因为Al(OH)3溶于强酸、强碱,而不溶于弱碱,所以选D。
4.D解析:由题给条件,可知将甲蒸发掉一半水分,溶质的量并未发生变化,故完全反应时消耗的盐酸应与丙相同,甲丙很容易判断。由于存在如下关系式:2NaOH-Na2CO3-2HCl,可知向乙中通入量CO2后部分NaOH变为Na2CO3,而生成的Na2CO3在与盐酸反应时会消耗与NaOH变质前等量的盐酸,故完全反应后,所需盐酸溶液的体积应是相等的,即甲=乙=丙。
3.C解析:0.8gNaOH若全部转化成Na2CO3,则其质量为1.06g<1.37g;若全转化成NaHCO3,则其质量应为1.68g>1.37g。故NaOH吸收CO2时实际上生成了Na2CO3(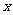 mol)和NaHCO3(
mol)和NaHCO3(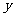 mol)的混合物。依Na原子守恒,得2
mol)的混合物。依Na原子守恒,得2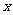 +
+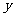 =0.02,且有:106
=0.02,且有:106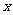 +84
+84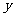 =1.37,解得
=1.37,解得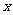 =0.005mol,
=0.005mol,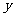 =0.01mol,故通人CO2的物质量为
=0.01mol,故通人CO2的物质量为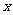 +
+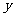 =0.015mol,质量为0.015mol×44g·mol-1=0.66g。
=0.015mol,质量为0.015mol×44g·mol-1=0.66g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com