
1.近年来开始使用一种新型汽油防震剂五羰基合铁Fe(CO)5来代替四乙基铅(C2H5)4Pb,在上述两种化合物中铁、铅两元素的化合价分别是
A.+2 +2 B.+3 +4 C.+3 0 D.0 +4
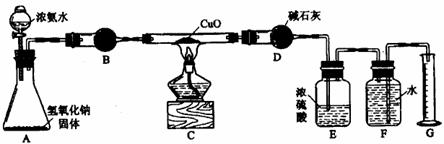
(1)写出氨气与氧化铜反应的化学方程式 。
(2)在A的锥形瓶中放入NaOH固体的目的是
。
(3)在干燥管B里不能选用的干燥剂是(填序号) 。
A. 碱石灰 B. 生右灰 C. 五氧化二磷 D. 氢氧化钠
(4)在C的玻璃管中观察到的现象是 。
(5)E装置中盛装浓硫酸的目的是 。
(6)待实验完毕后,若实验测得N2的体积为aL(已折算成标准状况),则被还原的氧化铜的物质的量为 mol(用含a字母的代数式表示);若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。
(7)上述实验中,如果省去B装置,测定氨分子组成的N、H原子个数的比值将会(填“增大”、“减小”或“无影响”) ,理由是
。
(1)晶体A是(化学式) ;
(2)反应②的离子方程式: ;
(3)根据图示信息,反应④的化学方程式为_________________________________________;由此判断:足量B的浓溶液与单质X共热时能否产生E_______(填“能”或“否”)。
(4)在反应⑤中,若生成物G与H的物质的量之比为4:1,写出F溶液与Na2O2反应的化学方程式: 。
A.NO2 B.NO C.O2 D.NO或O2
(1)选择最佳反应途径:
如用铜制硝酸铜: 。
用铝制氢氧化铝: 。
(2) 选择最佳原料:
如用氯化铝溶液制氢氧化铝: 。
用可溶性铜盐制氢氧化铜: 。
(3)选择适宜操作方法:
如制氢氧化亚铁:
。
(4) 选择适宜收集分离方法:
如制乙酸乙酯: 。
制溴苯: 。
试题枚举
[例1](05年江苏20)硫酸亚铁(FeSO4•7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4•7H2O晶体:
① 将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗2-3遍;
② 向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50-80℃之间至铁屑耗尽;
③ 趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④ 待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,再用滤纸吸干晶体;
⑤ 将制得的FeSO4•7H2O晶体放在一个小广口瓶中,密闭保存。回答下列问题:
(1)实验步骤①的目的是 ,加热的作用是 。
(2)实验步骤②明显不合理,理由是 。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是 。
解析 本题是以高三教材实验制取硫酸亚铁为载体变形与创新设设的实验综合题。涉及到盐类的水解,物质的溶解、结晶等知识,该题涉及知识面广,能力要求较高,属较难题。
答案(1)除去油污;升高温度,溶液碱性增强,去油污能力增强。
(2)应该铁屑过量(或反应后溶液中必须有铁剩余),否则溶液中可能有Fe3+存在,
(3)洗涤除去晶体表面附着的硫酸等杂质,用冰水洗涤,可降低洗涤过程中FeSO4·7H2O的损耗
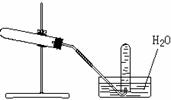 [例2]右图装置可用于( )
[例2]右图装置可用于( )
A.加热无水醋酸钠和碱石灰混合物,制取甲烷
B.加热硝酸铅制取二氧化氮
C.加热氯酸钾和少量二氧化锰,制取氧气
D.加热氯化铵和消石灰混合物,制取氨气
解析 该装置用于加热固体反应物制取难溶于水的气体,A-D各选项中,反应物均为固体,但氨气易溶于水,二氧化氮与水反应。只有甲烷和氧气可以用排水集气法收集。
答案 AC
[例3]实验室制取氯气时涉及到以下几个实验步骤:
a.把烧瓶固定在铁架台上,在烧瓶上装好分液漏斗并连接好导气管;
b.用药匙把少量MnO2粉末放入烧瓶中,再向分液漏斗中加入浓盐酸,并把导气管插入集气瓶中,同时连接好吸收多余氯气的尾气吸收装置;
c.把酒精灯放在铁架台上,根据酒精灯高度固定好铁圈,放好石棉网;
d.用分液漏斗向烧瓶内注入浓盐酸,再点燃酒精灯,缓缓加热;
e.检查装置气密性。
以上步骤先后排列的正确顺序是 ,实验室制得的 Cl2 中常混有 HCl气体和水蒸气,应将该 Cl2 依次通过盛有 、 的洗气瓶。
解析 一般地,实验室制取气体的正确的操作顺序是:首先按“由下往上,从左到右”的原则搭建气体发生装置,然后检查装置的气密性,最后加药品、制取气体。HCl 气体极易溶于水,故可用水将它除去;为降低 Cl2 在水中的溶解度,常用饱和食盐水代替水。能干燥 HCl 气体的干燥剂很多,如浓硫酸、无水氯化钙、五氧化二磷等,但盛放在洗气瓶中的只有浓硫酸。
答案 c a e b d 水(或饱和食盐水) 浓硫酸。
有三种:①用倒扣漏斗------极易溶于水的气体;②玻璃管----能溶于水或溶于溶液的气体的吸收(如用NaOH溶液吸收Cl2);③点燃法----处理CO。
要根据反应物的性质及实验条件来分析可能含有的杂质,再根据主要成分与杂质性质上的差异选择除杂方案。
一般净化气体时,除去水蒸气的干燥装置放在最后。用作干燥剂的物质须具备两个条件:一是本身要具有很强的吸水性,二是不能与被干燥的气体发生反应。实验室常用的干燥剂可划为三类:
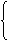 浓硫酸 禁用于碱性和还原性物质如NH3 HI
HBr H2S
浓硫酸 禁用于碱性和还原性物质如NH3 HI
HBr H2S
 酸性干燥剂
酸性干燥剂
五氧化二磷 禁用于碱性物质,如NH3
中性干燥剂 无水氯化钙 禁用于NH3和酒精
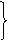
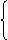 固体CaO
固体CaO
碱性干燥剂 禁用于酸性物质如HCl、Cl2、CO2
碱石灰(NaOH+CaO)
常见气体的干燥装置有两种:
洗气瓶:可装液体干燥剂,如浓硫酸;干燥管:可装固体干燥剂
|
气体洗涤装置 |
液体洗涤剂 |
固体洗涤剂 |
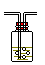 |
 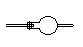 |
3.已经集满比空气轻的气体的集气瓶,放置时瓶口向 ;反之,已经集满比空气重的气体的集气瓶,放置时瓶口向 。
2.排空气法收集气体适用收集气体的密度与空气相差 ,且常温下不与空气反应的气体。收集有毒气体时,应增加 装置,如收集氯气时,应用 吸收。
气体的收集装置通常分为排水集气法、向上排空气法和向下排空气法三种:
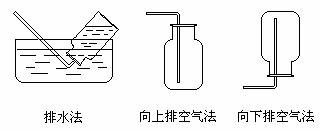
1.凡是 的气体都可以用排水法收集。用排水法集气时,盛满水的集气瓶应 在水槽里,收集满气体后,应在水下用 盖严,用此法收集得到的气体纯度 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com