
3.(1996年上海高考题)(1)1986年,化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:
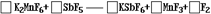
反应中 元素被还原。
(2)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素
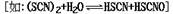 ,它们阴离子的还原
,它们阴离子的还原
性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出:
①(CN)2与KOH溶液反应的化学方程式:
;
②NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式: 。
(本题考查了氧化还原反应的配平、规律以及知识迁移和应用信息的能力。用化合价升降法配平并结合氯气的一些反应进行迁移。)
2.(2002年全国高考题)碘跟氧可以形成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是
A. I2O3 B.12O4
C. I4O7 D.I4O9
(本题考查物质化学式的书写能力,仿照盐的化学式并明确两处碘的化合价从而得出结论。)
5.为防止碘缺乏病,常在食盐中加入一定量的碘酸钾。
典型题点击
4.卤化银的性质及卤素离子的检验
AgF白色易溶于水,AgCl、AgBr、AgI颜色由白色到淡黄色到黄色,均不溶于水且溶解度越来越小,卤化银具有感光性。利用卤化银的性质可以用酸化的AgNO3(aq)来检验卤素离子(Cl-、Br-、I-)。此外,也可以在含有卤素离子的溶液中滴入氯水,再加入有机溶剂振荡后,观察有机层颜色。
3.卤素单质的化学性质
与氯气类似,按F2、Cl2、Br2、I2的顺序氧化性逐渐减弱。(1)与金属反应,与绝大多数金属(在点燃或灼烧的条件下)直接反应,生成高价卤化物(I2除外,如与铁反应生成亚铁盐)。(2)与H2反应,递变规律如下:
F2 Cl2 Br2 I2
条 件 暗处→光照(Δ)→ 加热→边加热边分解
现 象 爆炸→爆炸(或燃烧)现 象 不 明 显
 产物稳定性
减弱
产物稳定性
减弱
 产物酸性
增强
产物酸性
增强
 产物还原性
增强
产物还原性
增强
(3)与水反应,F2与水剧烈反应故而无“氟水”,Br2、I2与水作用越来越微弱。(4)卤素单质间的置换反应,按Cl2、Br2、I2的顺序,前面的单质能从盐溶液中置换出后面的单质,F2遇盐溶液先和水反应。(5)与低价态物质反应,如SO2、Na2SO3等。
2.卤素单质在物理性质上的差异性及递变规律
F2 Cl2 Br2 I2
状 态 气态 气态 液态 固态
淡黄绿色、黄绿色、红棕色、紫黑色
 颜 色
加深
颜 色
加深
(H2O)反应 溶解 溶解 微溶
 溶解度
逐渐减小
溶解度
逐渐减小
 熔沸点
升高
熔沸点
升高
Cl2、Br2、I2易溶于有机溶剂(苯、CCl4、CS2、汽油等),一般分别呈黄色、橙色、紫色,碘在酒精中呈黄褐色。液溴存放时用水封,碘易升华。
1.卤族元素包括F、Cl、Br、I、At五种元素,其原子最外层7个电子,在反应中易得到一个电子,显示强非金属性。随着电子层数的递增,原子半径逐渐增大,元素的非金属性逐渐减弱,而金属性逐渐增强。在自然界都以化合态存在。
23.(10分)Na2S2O3·5H2O(俗称海波)是照相业常用的一种定影剂,常采用下法制备:将亚硫酸钠溶液与硫粉混合共热,生成硫代硫酸钠Na2SO3+S Na2S2O3,滤去硫粉,再将滤液浓缩、冷却,即有Na2S2O3·5H2O晶体析出。该法制得的晶体中常混有少量Na2SO3和Na2SO4的杂质。为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的H2SO4溶液20 mL,充分反应后滤出硫,并将滤液微热(假定生成的SO2全部逸出),测得有关实验数据如下(标准状况):
Na2S2O3,滤去硫粉,再将滤液浓缩、冷却,即有Na2S2O3·5H2O晶体析出。该法制得的晶体中常混有少量Na2SO3和Na2SO4的杂质。为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的H2SO4溶液20 mL,充分反应后滤出硫,并将滤液微热(假定生成的SO2全部逸出),测得有关实验数据如下(标准状况):
|
|
第一份 |
第二份 |
第三份 |
|
样品的质量/g |
12.60 |
18.90 |
28.00 |
|
二氧化硫的体积/L |
1.12 |
1.68 |
2.24 |
|
硫的质量/g |
1.28 |
1.92 |
2.56 |
(1)样品与硫酸可能发生反应的离子方程式为 。
(2)根据上表数据分析,该样品 (填选项字母)
A.只含有Na2S2O3
B.含有Na2S2O3和Na2SO3两种成分
C.含有Na2S2O3、Na2SO3和Na2SO4三种成分
(3)试计算:该样品中各成分的物质的量之比。
(4)求所加硫酸溶液的物质的量浓度是多少?
(5)若将63g该样品与一定量的该硫酸溶液微热,欲计算生成SO2的体积,还需要提供的一个数据是(用a表示该数值,并注明单位) 。
试讨论:当a在不同取值范围时,SO2的体积b。并请在图上画出b随a变化的曲线。
22.(8分)在标准状况下,将质量为相同状况下同体积氢气质量16倍的CO2和CO的混合气体,充入盛有足量Na2O2且容积为2.24 L的密闭容器中(固体的体积忽略不计),用间断发生的电火花引发反应,使可能发生的反应充分进行。试计算:
(1)反应前充入容器中的CO2和CO的物质的量各是多少?
(2)最后容器中的生成物有哪些?其质量各是多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com