
7.+5;7。
讲析:由电荷守恒知n=1,则RO3-中R元素的化合价是+5价,因在生成物中有R-,可知R得一个电子即达到稳定结构,故其最外层电子数是7。
6.(1)D;(2)A、C;(3)I-+6OH--6e-= IO3-+3H2O,
|
6H++6e-=3H2↑,KI+3H2O KIO3+3H2↑
讲析:缺碘产生的病症是地方性甲状腺肿(大脖子病);KI中的碘离子具有强还原性且口感苦涩;电解KI溶液时阳极上是I-放电,阴极上是H+(水电离的)放电。
1.D;2.B、D;3.B;4.B;5.B;
讲析:1.从卤族元素的单质极其化合物的性质迁移可得出,砹单质的颜色比碘深、砹的氢化物不如碘化氢稳定、砹单质还不及碘与水的反应、砹的非金属性比碘弱。2.漂白粉的有效成分是氯酸钙,碘单质能使淀粉变蓝,A、C错误。3.单质的熔沸点逐渐升高,气态氢化物稳定性逐渐减弱,单质氧化性逐渐减弱,A、C、D错误。4.熟知有关卤素知识:①单质氧化性Cl2>Br2>I2,阴离子的还原性I->Br->Cl-;②碘单质能使淀粉变蓝,溴水为橙色。由此可推断出甲中加淀粉溶液和氯水,溶液变为橙色,说明甲中有Br-,再加丙溶液,颜色无明显变化,则说明丙中无I-。5.(1)采用极值法,若95mg全为氯化镁,则生成沉淀为287mg,小于300mg,当95mg全为杂质时,产生的沉淀的质量应大于300mg。则杂质写成MxCl2,xM的式量应小于镁的相对原子质量24,只有氯化铝行。
(2)采用平均值法,由MxCl2→2AgCl,得混合物的平均式量为90.9,氯化镁的式量为95,杂质的式量应小于95才符合题意。
4.每千克食盐中含KIO345mg,为合格食盐。
讲析:由题给的两个方程式可找出关系式:
KIO3→3I2→6 S2O32-,则每千克食盐中含KIO3的质量

新活题网站
3.(1)2、4、4、2、1,Mn(或);
(2)①(CN)2+2KOH=KCN+KCNO+H2O,
②2SCN-+(CN)2=2CN-+(SCN)2。
讲析:(1)用化合价升降法配平。①(CN)2与KOH的反应相当于Cl2与KOH的反应;②由于阴离子的还原性Br-<CN-<SCN-,单质的氧化性Br2>(CN)2>(SCN)2,故(CN)2只能氧化SCN-而不能氧化Br-。
1. B;2.D。
讲析:1.从题给的反应出发,要证明食盐中存在
IO3-,必须有I-和6H+参加反应才生成I2,再用淀粉检验之。 2.碘酸根的化学式为IO3-,其中碘元素呈+5
价,另一碘原子呈+3价,碘酸碘应写成I(IO3)3,即I4O9。
15.宇航员在研究某星球的大气时,测知其主要成分是一种易溶与水的气体A;用酸化的KMnO4溶液与A的水溶液共热时,可获得一种棕红色气体产物B,B冷却至室温即凝为液体;B与碱反应生成两种盐。据此推断该大气主要成分A是 (填化学式)。它与KMnO4溶液反应的化学方程式为 ,
B与冷的KOH反应的离子方程式是 。
实验室收集一瓶A气体,倒立在盛水的水槽中,水上升
9/10体积。问:
(1)原气体的平均相对分子质量是多少?
(2)假如溶质不扩散,瓶中溶液的物质的量浓度是多少?
14.制取氟氯化合物X,可采用特制的耐氟仪器。制备X的反应物是10%的HCl04溶液和F2,使它们缓缓反应,产率不很高。化合物X中元素质量分数是:Cl 30%;O 54%;F 16%,且X的最简式式量与相对分子质量相同。有关物质的资料如下:
①无水KF为固体,易吸收F2、HF和H2O;
②化合物X的熔点-167.5℃,沸点-15.9℃,易分解,若接触有机物容易爆炸;
③F2沸点-188.14℃,HF沸点19.54℃,O2沸点-183℃,NH3沸点-33.35℃。实验装置如图所示。试回答:
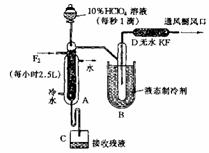
(1) X的化学式是 。
(2) HCl04与F2生成X的化学方程式为:
。
(3) D装置的作用是 。
(4)B中致冷液用 (填“液氧”或“液氨”),其理由是 。
(5)A的内管中填充许多耐氟的环状物,其主要作用是使气流曲折向上,液流迂回而下,扩大接触面,力求反应充分。若把A内管的环状填充物换成耐氟的石墨环,则X的产率为0,请推测其主要原因是
。
13.(1)为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4•7H2O进行消毒、杀菌,以改善水质,其原因是
。
 (2)为了延长液氯杀菌时间,某些自来水厂在用液氯进行消毒处理时,还加入少量液氨,其反应的化学方程式为:NH3+HClO H20+NH2Cl(一氯氨)。已知NH2Cl比HClO稳定,试分析加液氨能延长液氯杀菌时间的原因
(2)为了延长液氯杀菌时间,某些自来水厂在用液氯进行消毒处理时,还加入少量液氨,其反应的化学方程式为:NH3+HClO H20+NH2Cl(一氯氨)。已知NH2Cl比HClO稳定,试分析加液氨能延长液氯杀菌时间的原因
。
12.氯、溴、碘同属元素周期表的ⅦA。20世纪人们很早就得到了HCl04和HI04及其盐,但无论用什么方法都得不到+7价溴的化合物。因此很长一个时期,人们认为溴不会表现+7价。1968年化学家 Appolman发现用XeF2和HBrO3反应,首次检出 Br04-,随后在1971年用XeF2和含KOH的KBrO3水溶液反应,得到了很纯的KBr04晶体。
(1)已知XeF2与水反应放出氧气和氙气,氟则以化合态留在水溶液里,写出配平的化学反应方程式
该反应的氧化剂是 ,被氧化的元素的是 。
(2)写出XeF2和含KOH、KBrO3水溶液反应得到KBr04晶体的化学方程式 。
(3)由上述信息指出BrO4-的稳定性随溶液pH增大而
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com