
11.(1)碳或(C)
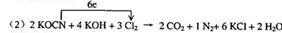
(3)35.5
讲析:(1)标出化合价,碳由+2→+4被氧化。
(2)根据化合价升降法配平。
(3)20L废水中含KCN 0.2mol,由电子守恒知需Cl2 0.5mol。
|
(2)XeF2+2KOH+KBrO3=KBr04+Xe↑+2KF+2H2O。(3)升高。
讲析:前两问用化合价升降法配平,第(3)问由信息进行分析可知:把HBrO3换成含KOH的KBrO3水溶液就得到了很纯的KBr04晶体,说明在碱性条件下易生成BrO4-。
 13.(1)氯气与水反应:Cl2+H2O HCl+HClO,HClO有强氧化性起杀菌、消毒作用;氯气还能将Fe2+氧化:Cl2+2Fe2+=2 Fe3+,Fe3+水解:Fe3++3H2O Fe(OH)3(胶体),Fe(OH)3胶体能吸附水中的悬浮杂质,使之净化。
13.(1)氯气与水反应:Cl2+H2O HCl+HClO,HClO有强氧化性起杀菌、消毒作用;氯气还能将Fe2+氧化:Cl2+2Fe2+=2 Fe3+,Fe3+水解:Fe3++3H2O Fe(OH)3(胶体),Fe(OH)3胶体能吸附水中的悬浮杂质,使之净化。
(2)向含有Cl2的自来水中加入少量液氨,发生反应:
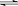 NH3+HClO
H20+NH2Cl,使不稳定的HClO转化为稳定的NH2Cl。随着消毒时HClO浓度的下降,平衡左移,HClO得以补充,从而延长液氯杀菌时间。
NH3+HClO
H20+NH2Cl,使不稳定的HClO转化为稳定的NH2Cl。随着消毒时HClO浓度的下降,平衡左移,HClO得以补充,从而延长液氯杀菌时间。
讲析:回答(1)从消毒、净化两方面入手,起作用的到底是什么?又为什么能生成这些物质?而(2)要从题给的平衡以及两物质的稳定性来考虑。
10.SO2;HBr;CO2、HCl。
讲析:该气体通入氯水中,得无色透明溶液说明无HBr;向溶液中加入盐酸酸化的BaCl2溶液,出现白色沉淀,说明有SO2。而CO2、HCl不能肯定。
8.C;9.B。
讲析:1.由氧化剂的氧化性大于氧化产物的氧化性
得出。 2.由于是置换反应,当X、Y都是金属时,X一定比Y活泼,当X是活泼金属(如Na)时,Y就是H2,所以A、C正确。B选项也应是X一定比Y活泼,D选项中当X是非金属时Y只能是非金属。3.金属元素(R)最高价氟化物的化学式为RFn,而其最高价的硫酸盐的化学式有两种R2(SO4)n(n为奇数)和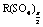 (n为偶数),设R是式量为X,列方程组解得。4.次氯酸钙与碳酸生成HClO(非氧化还原反应),它再在光照条件下分解(氧化还原反应)。5.氯化碘(ICl)与水反应,碘元素呈+1价与水中的OH-结合生成HIO,而氯呈-1价与水中的H+结合生成HCl。6.氟氯甲烷是产生氯原子的反应物,不是催化剂。7.A中ClO-、S2-,B中Fe3+、I-,D中H+、F-均不能大量共存。8.F2通入H2O中发生置换反应,生成HF20g,O28g。再算出HF的质量分数。9.A中HClO是弱酸不能拆开,C中用石灰乳应写成分子形式,D中Ag2CO3属于难溶物不能拆开。
(n为偶数),设R是式量为X,列方程组解得。4.次氯酸钙与碳酸生成HClO(非氧化还原反应),它再在光照条件下分解(氧化还原反应)。5.氯化碘(ICl)与水反应,碘元素呈+1价与水中的OH-结合生成HIO,而氯呈-1价与水中的H+结合生成HCl。6.氟氯甲烷是产生氯原子的反应物,不是催化剂。7.A中ClO-、S2-,B中Fe3+、I-,D中H+、F-均不能大量共存。8.F2通入H2O中发生置换反应,生成HF20g,O28g。再算出HF的质量分数。9.A中HClO是弱酸不能拆开,C中用石灰乳应写成分子形式,D中Ag2CO3属于难溶物不能拆开。
1. B;2.A、C;3.A、B;4.C;5.B;6.C;7.C
4.(1)BrCl3+2SO2+4H2O=2H2SO4+HBr+3HCl (2)n=3
讲析:(1)BrCl3是强氧化剂,必然是溴元素的化合价下降生成HBr,SO2作为还原剂生成H2SO4,确定了反应物和生成物,写出方程式配平即可。
(2)先找出关系式:
BrCln→HBr+nHCl→AgBr+nAgCl,然后再列比例式解题。
检测提高
3.(1)x=3
(2)3BrF3+5H2O=HBrO3+9HF+Br2+O2
(3)3BrF3;3BrF3和H2O
讲析:由题目提供的信息写出方程式再进行配平,满足质量守恒,求出x的值;再分析化合价的变化,找出氧化剂和还原剂。
1.B; 2.B、C。
讲析:1.溶液中存在Cl-、Br-、I‑三种离子,通入Cl2后先与I‑反应,原来三者物质的量之比是1:2:3,后来变成3:2:1,说明I‑没有完全反应,I‑少了两份,通的Cl2为一份,故Cl2与I‑物质的量之比是1: 3。 2.IBr分子中两非金属原子之间以共价键结合,它属于分子晶体,又因碘元素呈+1价IBr可以作为氧化剂,A、D选项说法正确。IBr与水反应生成HIO和HBr元素化合价无变化且无I‑。
10.96.6%。
讲析:由Ca(ClO)2的含量算出CaCl2的含量为42.83%,未反应的Ca(OH)2为2%。设该漂白粉为100g,Ca(ClO)2 、CaCl2共98g,则未反应的Ca(OH)2为2g。根据制取漂白粉的化学方程式可求出参加反应的
Ca(OH)2为57.1g,则可算出消石灰的利用率为96.6%。
第21课时 (B卷)
纠错训练
9.①碘化钾、生石灰;②Cl2+2KI=2KCl+I2,
Br2+2KI=2KBr+I2;CaO +H2O=Ca(OH)2。③混合物放在烧杯里,烧杯用一个盛有冷水的烧瓶盖上。加热时碘发生升华,蒸气遇冷凝结在烧杯底部外侧而与杂质分离。
讲析:先加2KI, Cl2、Br2转化为KCl、KBr。用吸水剂CaO吸水,再利用碘易升华的性质,通过升华法将碘与固体分离。
8.(1)3Br2+3CO32-=5Br-+BrO3-+3CO2↑;
(2)5Br-+BrO3-+6H+=3Br2+3H2O。
讲析:由题目提供的信息不难写出参加反应的物质,配平时要注意三大守恒的顺序。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com