
0.1mol·L-1醋酸的电离度为1.3%)
(2)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2 (s) Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+) · c2(OH-)=2×10-20。
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+) · c2(OH-)=2×10-20。
①某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH
使之大于 。
②要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),
则应向溶液里加入氢氧化钠溶液使溶液pH为 。
18.(12分)(1)已知25℃时0.1mol·L-1醋酸溶液的pH约为3。向其中加入少量醋酸钠晶体, 待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释: 甲同学认为醋酸钠水解呈碱性, 增大了c(OH-), 因而溶液的pH增大; 乙同学认为醋酸钠溶于水电离出大量醋酸根离子, 抑制了醋酸的电离, 使c(H+)减小, 因此溶液的pH增大。你认为上述两种解释中 (“甲”或“乙”)正确。
①为了验证上述哪种解释正确, 继续做如下实验: 向0.1mol·L-1的醋酸溶液中加入少量下列物质 (填写编号), 然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
②若 (填“甲”或“乙”)的解释正确, 溶液的pH应 (填“增大”、“减
小”或“不变”)。(已知: 25℃时, 0.1mol·L-1氨水的电离度为1.3%,
17.(14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | | ⑧ | |
(1)④、⑤、⑥的原子半径由大到小的顺序为______。
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是______。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______ 。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
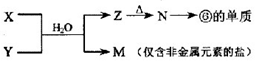
X溶液与Y溶液反应的离子方程式为_________ ,
N→⑥的单质的化学方程式为________________ 。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至__________。
16.(12分) 生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2 等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子
排布式
(2)根据等电子原理,写出CO分子的结构式 。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2 的碱性溶液反应生成Cu2O 沉淀。
①甲醇的沸点比甲醛的高,其主要原因是 ;
甲醛分子中碳原子轨道的杂化类型为 ;
 ②甲醛分子的空间构型是 ;
②甲醛分子的空间构型是 ;
1mol甲醛分子中σ键的数目为 。
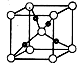
③在1个Cu2O 晶胞中(结构如图所示),所包含的Cu 原子数目
tgh为 。
15.(10分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
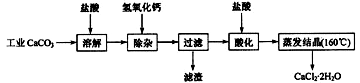
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量 Al3+、
Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3 沉淀完全。反应的离子方程式 。
(2)酸化操作是加入盐酸,调节溶液的pH为4.0,其目的有:①将溶液中的少量Ca(OH)2 转化为CaCl2;②防止Ca2+在蒸发时水解;③ 。
(3)测定样品中Cl-含量的方法是:
a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测液于锥形瓶中;c.用0.05000mol·L-1 AgNO3 溶液滴定至终点,消耗AgNO3 溶液体积的平均值为20.39mL。
①上述测定过程中需用溶液润洗的仪器有: 。
②计算上述样品中CaCl2·2H2O的质量分数为: 。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可
忽略),其可能原因有: ; 。
14.已知:反应H2A+B-(足量)=HA-+HB和H2A+2C-(足量)=2HC+A2-,则下列说法正确的
是
A、若将pH=3的H2A的溶液和pH=11的NaOH溶液等体积混合,则溶液呈酸性
B、HA-、B-、C-、A2-结合质子能力由强到弱得顺序为HA->C->A2->B—
C、HC和B-间可发生反应:HC+B-=HB+C-
D、物质的量浓度均为1mol·L-1的HB溶液和NaOH溶液等体积混合后,溶液呈酸性
非选择题(72分)
13.科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。一定条件下给水施加
一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如下。


水 热冰
下列关于“热冰”叙述正确的是
A.使水结成“热冰”采用“弱电场”的条件,说明水分子是极性分子
B.“热冰”中的水分子之间是以共价键结合在一起的
C.“热冰”中的水分子之间是以氢键结合在一起的
D.“热冰”的化学性质与水的化学性质差别很大
12.下列叙述正确的是
A. Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
B. 0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(OH-)>c(H+)
C.pH=5的CH3COOH溶液和pH =5的NH4Cl溶液中,c(H+)不相等
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
11.下列叙述正确的是
A、1个甘氨酸分子中存在9对共用电子
B、PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
C、熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
D、H2S和CS2分子都是含极性键的极性分子
10.下列溶液中微粒的物质的量浓度关系正确的是:
A.室温下,向0.01mol·L-NH4HSO4 溶液中滴加NaOH 溶液至中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
B.0.1mol·L-1NaHCO3溶液: c(Na+)>c(OH-)>c((HCO3-)>c(H+)
C.Na2CO3溶液中:c(OH-)-c(H+)=c((HCO3-)+2c(H2CO3)
D.25℃时,pH=4.75、浓度均为0.1mol·L-1的CH3COOH、CH3COONa 混合溶液:
c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com