
4、分类是化学学习和研究中常用的思维方法,下列关于反应类型关系正确的是


A B
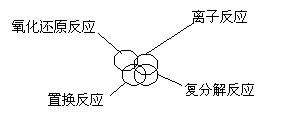

C D
3、以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,可推知MnS具有的相关性质是
A.具有吸附性 B.溶解度与CuS、PbS、CdS等相同
C.溶解度大于CuS、PbS、CdS D.溶解度小于CuS、PbS、CdS
2、下列关于化学基本原理和基本概念的几点认识中正确的是
A.胶体区别于其他分散系的本质特征是丁达尔现象
B.一般认为沉淀离子浓度小于1.0×10-5mol/L时,则认为已经沉淀完全
C. NaCl既可表示氯化钠的组成,又能表示其分子式
D.强电解质溶液的导电能力强于弱电解质溶液
1.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:
3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M。关于该反应的说法中正确的组合是
① 氧化剂是H3AsO3;② 还原性:Cl->As;③ 每生成7.5gAs,还原剂失去的电子为0.3 mol;④ M为OH-;⑤ SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
21.[江苏省江安中学2009届高三年级第三次月考 ]食品检验是保证食品安全的重要措施,下列哪些物质的含量是在食品中是严格控制的[ D ]
①烧烤食品中苯并芘的含量 ②奶粉中三聚氰胺的含量
③亚硝酸盐的含量 ④苯甲酸钠的含量
A.①②③ B.①③④ C.②③④ D.①②③④
20.[江苏省江安中学2009届高三年级第三次月考 ](12分)奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是:食品与硫酸和催化剂一同加热消化,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
(1)样品处理:准确称取一定量的固体样品奶粉,移入干燥的凯氏烧瓶中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
(2)NH3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸氨,再经过再经过碱化蒸馏后,氨即成为游离状态,游离氨经硼酸吸收。
(3)氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,从消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
试回答下列问题:
(1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水?



。 (2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大( )
A、凯氏烧瓶中溶液转移移到容量瓶中时,未洗涤凯氏烧瓶
B、定容时,俯视刻度线
C、定容时,仰视刻度线
D、移液时,有少量液体溅出
(3)若称取样品的质量为1.5g,共配制100毫升的溶液,取其中的20mL,经过一系列处理后,使N转变为硼酸铵然后用0.1mol/L盐酸滴定,共用去盐酸的体积为23.0mL,则该样品中N的含量为
。
已知:滴定过程中涉及到的反应方程式:(NH4)2 B4O7
+ 2HCl + 5H2O = 2NH4Cl
+ 4H3BO3
(4)一些不法奶农利用“凯氏定氮法”只检测氮元素的含量而得出蛋白质的含量这个检测法的缺点,以便牛奶检测时蛋白质的含量达标,而往牛奶中添加三聚氰胺(C3N6H6)。则三聚氰胺中氮的含量为
。
答案. (1)往容量瓶中注入一定量的水,塞紧瓶塞,倒转过来,观察是否漏水,然后再正放,旋转瓶塞1800,又倒转过来,观察是否漏水,若都不漏水,则说明该容量瓶不漏水。
(2)B
(3)10.73%
(4)66.7%
19.[江苏省口岸中学2009届高三年级第二次月考化学试题](6分)5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的离子方程式:
。
(2)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H+ +Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子数是 。
(3)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是 。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
答案.(1)2ClO3-+SO2=2ClO2+SO42- (2)0.8NA (3)B
18、[江苏省口岸中学2009届高三年级第二次月考化学试题] (11分)人类对氢气的研究更趋深入,“氢能”将是未来最理想的新能源。
(1)实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为___________ ________________。
(2)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。(提示:反应②的产物是O2、SO2和H2O)

完成下列反应的化学方程式:反应①______________;反应②_____________________。此法制取氢气的最大优点是_____________________________。 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
(3)目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇:
CO(g)+2H2(g)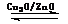 CH3OH(g)。甲醇的物质的量与反应温度的关系如下图所示:
CH3OH(g)。甲醇的物质的量与反应温度的关系如下图所示:

①合成甲醇反应,其反应热△H______0。(填“>”、“<”或“=”)
②据研究,合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示)_______________________________________。
答案.. (1) 2H2(g)+O2(g)==2H2O(g)△H=-571.6KJ/mol (2分)
(2) ①:SO2+I2+2H2O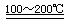 2HI+H2SO4(2分)
②:2H2SO4
2HI+H2SO4(2分)
②:2H2SO4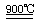 2SO2↑+O2↑+2H2O
(2分) SO2和I2 可循环使用,无污染。(2分)
2SO2↑+O2↑+2H2O
(2分) SO2和I2 可循环使用,无污染。(2分)
③:①:<
(1分) ②:Cu2O+CO Cu+CO2
(2分 不写可逆号扣1分)
Cu+CO2
(2分 不写可逆号扣1分)
17.[江苏省姜堰市姜淮培训中心2009届高三化学周练九]2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球 “最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜, 并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是[ C ]
并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是[ C ]
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2
C.用金属铝与V2O5冶炼钒,铝作还原剂
D.ETFE膜( )是由两种单体缩聚而成的
)是由两种单体缩聚而成的
16.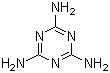 [江苏省姜堰市姜淮培训中心2009届高三化学周练九](14分)近期有两件事引起了人们的极大关注。
[江苏省姜堰市姜淮培训中心2009届高三化学周练九](14分)近期有两件事引起了人们的极大关注。
(1)“问题奶粉”①其问题主要是掺杂了三聚氰胺,该物质的结构如图,该物质的含氮量为 ,蛋白质是由不同氨基酸组成的,根据组成的不同,其含氮量一般在15~17.6%之间变化。而农业用氮肥中包括碳酸氢铵、硝酸铵以及尿素,含氮量依次增加,以尿素最高,理论值为 现代工业合成三聚氰胺主要使用尿素为原料,在加热和一定压力条件下生成该物质及氨和二氧化碳,试写出化学方程式
_______________________
②该物质遇强酸或强碱水溶液水解,氨基逐步被羟基取代,先生成三聚氰酸二酰胺,进一步水解生成三聚氰酸一酰胺,最后生成三聚氰酸。经研究表明三聚氰胺和三聚氰酸在肾细胞中结合沉积从而形成肾结石,堵塞肾小管,最终造成肾衰竭。试写出三聚氰胺生成三聚氰酸的化学方程式 。
(2) “神七问天” ①联氨(N2H4)是航天飞船常用的高能燃料。联氨是一种无色可燃的液体,溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式: 。
②联氨也可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,写出其反应的化学方程式 。
③火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热。已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量;H2O(l)=H2O (g) DH=+44 kJ·mol-1 2H2O2(l)=2H2O(l)+ O2(g) DH=–196.4 kJ·mol-1则写出表示联氨燃烧热的热化学方程式为 。
答案..(14分)(1)66.7%(2分), 46.7%(2分),
6 (NH2)2CO → C3H6N6 + 6 NH3 + 3 CO2(2分)
②C3H6N6+3H2O=C3N3(OH)3+3NH3
(2) ①N2H4+H2O NH2NH3+(N2H5+)+OH- (2分)
NH2NH3+(N2H5+)+OH- (2分)
(NH2NH3++
H2O NH3NH32++OH- )
NH3NH32++OH- )
② CO(NH2)2+ NaClO+ 2NaOH = N2H4+NaCl+Na2CO3 +H2O (2分)
③N2H4(l)+O2(l)=N2(g)+2H2O(l) ΔH=-621.23 kJ·mol-1 (2分)
w.w.w.k.s.5.u. c.o.m
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com