
14、常温下,0.1 mol·L-1某一元酸(HA)溶液中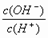 =1×10-8,下列正确的是
=1×10-8,下列正确的是
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.0.1mol/L的NaA溶液中的离子浓度大小关系为:c(Na+)>c(A-) >c(H+)>c(OH-)
C.该溶液中水的离子积常数为1×10-22
D.用0.1 mol·L-1NaOH溶液V1 L 与0.1 mol·L-1该一元酸(HA)V2 L溶液混合,若混合溶液的pH = 7,则V1<V2
13、下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是
|
|
(I) |
(II) |
|
A |
少量SO2通入Ba(OH)2溶液 |
过量SO2通入少量Ba(OH)2溶液 |
|
B |
少量浓氨水滴入Al2(SO4)3溶液 |
少量Al2(SO4)3溶液滴入浓氨水 |
|
C |
0.1mol Cl2通入含0.2mol FeBr2的溶液 |
0.3 molCl2通入0.2molFeBr2溶液中 |
|
D |
过量BaCl2溶液与少量Na2SO4溶液相混合 |
少量Ba(NO3)2溶液与过量MgSO4溶液相混合 |
12、已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol
下列结论正确的是
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热为221kJ/mol
C.含1mol硫酸的稀溶液与含1mo氢氧化钡稀溶液反应放出的热量叫中和热
D.稀盐酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
11、下图是KNO3 和NaCl 的溶解度曲线。下列说法中正确的是
A.NaCl 的溶解度不受温度的影响
B.t1 0C时 ,100g KNO3 饱和溶液中含有20g KNO3
C.t2 0C 时 ,KNO3的饱和溶液和NaCl 的饱和溶液中溶质的质量分数不一定相等
D.温度高于t2 0C时, KNO3的溶解度大于NaCl 的溶解度

10、设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是
A.标准状况下,33.6 L H2O含有1.5NA个H2O分子
B.1.5 mol NO2与足量H2O反应,转移的电子数为NA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA
D.0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA
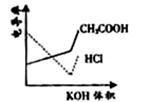
9、电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终应。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是

8、将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中作用是
A.酸 B.漂白剂 C.还原剂 D.氧化剂
7、可逆反应:2 NO2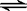 2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成n mol的O2同时生成2n mol NO2
②单位时间内生成n molO2时生成2n mol NO
③混合气体的平均相对分子质量不再改变的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦用NO2与NO、O2表示的反应速率的比为2:2:1的状态
A.①③④⑥ B.②③⑤⑦ C.①③④⑤ D.全部
6、叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3¯)>c(OH¯)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3¯)>c(OH¯)>c(H+)
D.N3¯与CO2含相等电子数
5、从植物花中提取一种有机物,可用简化式HIn表示,在水溶液中因存在下列电离平衡,可用作酸碱指示剂:HIn(红色溶液)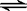 H+(溶液)+ In-(黄色溶液)。在水溶液中加入下列物质,能使指示剂显黄色的是
H+(溶液)+ In-(黄色溶液)。在水溶液中加入下列物质,能使指示剂显黄色的是
A.盐酸 B.Na2CO3溶液 C.NaCl溶液 D.过氧化钠
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com