
4. 反应物M和N在一定条件下反应生成MN:M+N
反应物M和N在一定条件下反应生成MN:M+N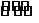 MN+Q,右图是生成物在不同温度和压强改变的条件下平衡混合物中的百分含量示意图,a为500℃,b为300℃,c为反应在300℃、时间
MN+Q,右图是生成物在不同温度和压强改变的条件下平衡混合物中的百分含量示意图,a为500℃,b为300℃,c为反应在300℃、时间 时向容器加压的情况,y表示M、N在混合物中的百分含量。问:
时向容器加压的情况,y表示M、N在混合物中的百分含量。问:
(1)反应热Q __ 0(填“>”、“=”、“<”)。
(2)a、b分别表示_____。
A.MN随时间变化的反应速率 B.MN生成速率随时间的变化
C.MN的百分含量随时间的变化 D.MN为气体,M、N都不是气体
E.M、N、MN均为气体 F.M、N中有一种不是气体,MN为气体
3.mA(s)+nB(g) 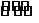 pC(g)+Q是可逆反应,在等温度条件下B的百分含量与压强p的关系如图,则( )
pC(g)+Q是可逆反应,在等温度条件下B的百分含量与压强p的关系如图,则( )
①m+n<p ②n>p ③X点时混合物的V正>V逆
④X点比Y点混合物的反应速率慢
A.①③④ B.②④ C.③④ D.①④
2. 对可逆反应mA(g)+nB(g)
对可逆反应mA(g)+nB(g)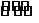 pC(g)+qD(g)+Q,开始时容器内充入A和B或C和C,右图分别表示反应达平衡后,改变压强和温度对反应速率和化学平衡的影响,则下列关系中正确的是( )
pC(g)+qD(g)+Q,开始时容器内充入A和B或C和C,右图分别表示反应达平衡后,改变压强和温度对反应速率和化学平衡的影响,则下列关系中正确的是( )
A.开始时充入A和B,m+n>p+q,Q>0
B.开始时充入A和B,m+n<p+q,Q<0
 C.开始时充入C和D,m+n>p+q,Q>0
C.开始时充入C和D,m+n>p+q,Q>0
D.开始时充入C和D,m+n<p+q,Q<0
1. 反应:
反应: ,从反应开始经
,从反应开始经 s达平衡状态,在
s达平衡状态,在 s末由于条件变化,平衡受到破坏,在
s末由于条件变化,平衡受到破坏,在 s时达到新的平衡,有右图表示上述反应过程中物质的浓度与反应时间的变化关系,图中
s时达到新的平衡,有右图表示上述反应过程中物质的浓度与反应时间的变化关系,图中 间曲线变化是哪种条件的改变引起的( )
间曲线变化是哪种条件的改变引起的( )
A.增大X或Y的浓度 B.增大压强
C.增大Z的浓度 D.降低温度
2.在密闭容器中进行如下反应: ,在温度T1和T2时,产物的量与反应时间的关系如下图所示。符合图示的正确判断是( )
,在温度T1和T2时,产物的量与反应时间的关系如下图所示。符合图示的正确判断是( )
A.T1>T2,正反应是吸热反应 B.T1>T2,正反应是放热反应
C.T1<T2,正反应是吸热反应 D.T1<T2,正反应是放热反应
[能力训练]
[知识归纳]
一般解图象题的方法为:(1)认准横、纵坐标的各表示量;(2)看清曲线的起点位置和变化趋势,及曲线余率的“平”与“陡”的意义;(3)准确把握特殊点为原点、曲线交点、拐点的含义;(4)结合平衡原理进行“图、理”分析。
[例题分析]
1. 右图是可逆反应
右图是可逆反应 的化学反应速率与化学平衡随外界条件改变,(先降温后加压)而变化的情况,由此判断( )
的化学反应速率与化学平衡随外界条件改变,(先降温后加压)而变化的情况,由此判断( )
A.正反应是放热反应
B.若A、B是气体则D是固体或液体
C.C、D为一定是气体
 D.A、B、C、D均为气体
D.A、B、C、D均为气体
2.在一定温度下体积固定的密闭容器中,当下列物理量不再变化时,能表明可逆反应 已达平衡的是( )
已达平衡的是( )
①混合气体的压强 ②气体的总物质的量 ③混合气体的密度 ④B的物质的量浓度
A.①② B.③④ C.①④ D.只有④
1.一定温度下容积固定的密闭容器中,当下列物理量不再发生变化时,表明反应 已达到平衡状态的是( )
已达到平衡状态的是( )
①气体的总物质的量 ②混合气体的压强 ③混合气体的密度 ④B的物质的量浓度
A.①②③ B.②③④ C.①②④ D.③
1.可逆反应 的正、逆反应速率可用各反应物或生成浓度的变化来表示。下列各类等式中能说明反应已达到平衡状态的是( )
的正、逆反应速率可用各反应物或生成浓度的变化来表示。下列各类等式中能说明反应已达到平衡状态的是( )
A. B.
B.
C. D.
D.
[能力训练]
2.化学平衡的标志:(1) ,具体分析中要落实到分析某一种物质浓度的消耗浓度与生成浓度相等上来;(2)体系中各物质的物质的量浓度或体积分数保持不变。
,具体分析中要落实到分析某一种物质浓度的消耗浓度与生成浓度相等上来;(2)体系中各物质的物质的量浓度或体积分数保持不变。
[例题分析]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com