
2.常见类型有:
(1)定温(T),定容(V)条件下的等效平衡。
Ⅰ类:对于一般可逆反应,在定T、V条件下,只改变起始加入情况,只要通过可逆反应的化学计量数比换算成平衡式左右两边同一边物质的量与原平衡相同,则二平衡等效。
Ⅱ类:在定T、V情况下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量的比例与原平衡相同,则二平衡等效。
(2)定T、P下的等效平衡
Ⅲ类:在T、P相同的条件下,改变起始加入情况,只要按化学计量数换算成平衡式左右两边同一物质的量之比与原平衡相同,则达平衡后与原平衡等效。
[例题分析]
[知识归纳]
1.等效平衡:即一定条件下起始加入物质的量不同,经转化后,成为同一种情况下建立的平衡。
4.在新制的氯水中存在平衡: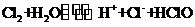 。若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
。若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
A.pH增大,HClO浓度减小 B.pH减小,HClO浓度增大
C.pH增大,HClO浓度增大 D.pH减小,HClO浓度减小
3.Fe(NO3)2溶液呈浅绿色,其中存在下列平衡: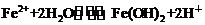 。往该溶液中逐滴加入盐酸,发生的变化是( )
。往该溶液中逐滴加入盐酸,发生的变化是( )
A.平衡向正反应方向移动 B.平衡向逆反应方向移动
C.溶液由浅绿色变为黄色 D.溶液由浅色变成深绿色
2.下列各组物质的颜色变化,可用勒沙特列原理解释的是( )
A.新制的氯水在光照条件下颜色变浅 B.H2、I2、HI平衡混合气加压后颜色变深
C.氯化铜溶液加铁粉后铁粉变成红棕色 D.加入催化剂有利于氨氧化的反应
1.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )
①生成物的体积分数一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂
2.下列颜色变化不能用勒夏特列原理解释的是( )
①红棕色的NO2加压颜色先变深后变浅 ②Fe(SCN)3溶液中加入KSCN固体后颜色变深
③在H2、I2(g)和HI组成的平衡体系中,加压,混合气体颜色变深
④I2水中加入少量NaOH颜色变浅 ⑤往H2S溶液中加碱有利于S2-的增多
⑥加催化剂有利于氨的氧化反应 ⑦500 左右比室温更有利于合成NH3的反应
左右比室温更有利于合成NH3的反应
A.①③⑤ B.④⑤⑥ C.③⑥⑦ D.④⑥⑦
[能力训练]
1.反应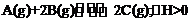 ,达到平衡后,将反应混合物的温度降低,下列叙述正确的是( )
,达到平衡后,将反应混合物的温度降低,下列叙述正确的是( )
A.正反应速率加快,逆反应速率变慢,平衡向正方向移动
B.正反应速率变慢,逆反应速率加快,平衡向逆方向移动
C.正反应速率和逆反应速率均加快,平衡不移动
D.正反应速率和逆反应速率均变慢,平衡向逆方向移动
2.运用上述原理时注意:①不要把v正增大与平衡向正反应方向移动等同起来,如平衡向正方向移动,生成物浓度不一定增大;②不要把平衡向正反应方向移动与原料转化率提高等同起来。
[例题分析]
[知识归纳]
1.平衡移动原理:如果改变影响平衡的一个条件(为温度、压强或浓度),平衡就向能够减弱这种改变的方向移动;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com