
10.(天津市汉沽一中2009第五次月考)根据等电子原理:由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们具有相似的结构特征。以下各组微粒结构不相似的是 ( )
A.CO和N2 B.O3和NO- C.CO2和N2O D.N2H4和C2H4
[解析]要吻合结构相似,就是去寻找互为等电子体的微粒,而D不吻合等电子体的要求。
[答案]D
[考点分析]本题主要考查等电子体的概念理解和应用。
9. (长春市实验中学2009届高三理科综合练习化学部分(四))下列事实与氢键有关的是
A. 水加热到很高的温度都难以分解
B. 水结成冰体积膨胀,密度变小
C. CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D. HF、HCl、HBr、HI的热稳定性依次减弱
[解析]由于形成氢键使水分子间间隙增大,使体积增大,密度减小。
[答案]B
[考点分析]本题主要考查氢键对物质物理性质的影响。
8.(四川宜宾市第三中学校2009届高三上半期考试理科综合)下列对一些实验事实的理论解释正确的是
|
选项 |
实 验 事 实 |
理 论 解 释 |
|
A. |
SO2溶于水形成的溶液能导电 |
SO2是电解质 |
|
B. |
白磷为正四面体分子 |
白磷分子中P-P间的键角是109°28′ |
|
C. |
1体积水可以溶解700体积氨气 |
氨是极性分子且由于有氢键的影响 |
|
D. |
HF的沸点高于HCl |
H-F的键长比H-Cl的键长短 |
[解析]A中SO2本身不导电,是非电解质;B中白磷分子中P-P间的键角是60°;D中是由于HF分子间能形成氢键;
[答案]C
[考点分析]本题考查了键角、氢键、熔沸点影响因素等知识点。
7.(2008山东卷)下列说法正确的是
A . SiH4 比CH4 稳定
B .O2-半径比 F― 的小
C. Na 和 Cs属于第 IA 族元素, Cs 失电子能力比 Na 的强
D . P 和 As属于第 VA 族元素, H3PO4 酸性比 H3 AsO4的弱
[解析]A中由于Si的非金属性小于C,所以SiH4没有CH4 稳定;B中O2-和 F― 的核外电子排布相同,核电荷数越大,离子半径越小;D中同主族元素,自上而下非金属性减弱,所以H3PO4 酸性比 H3 AsO4的强。
[答案]C
[考点分析]本题主要考查元素周期律的相关知识。
6.(2008江苏卷)下列排列顺序正确的是
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-
A.①③ B.②④ C.①④ D.②③
[解析]根据非金属性:F>O>S,可以判断热稳定性的顺序为:HF>H2O>H2S,同理可以判断酸性:HClO4>H2SO4>H3PO4,所以①、③错误。根据原子在元素周期表中的位置及原子半径的规律可以判断②正确。根据溶液的酸碱性可以判断④正确。所以答案为B。
[答案]B
[考点分析]本题主要考查原子结构及周期律的基本知识。
5.(2009四川卷10).X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是
A. 还原性:X的氢化物>Y的氢化物>Z的氢化物
B. 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C. YX2、M2Y都是含有极性键的极性分子
D. Z元素的最高价氧化物的水化物的化学式为HZO4
[解析]从题给信息可判断:X是O、Y是S、Z是Cl、M是K;A选项非金属性越强,氢化物的还原性越弱,所以A错;B选项电子层结构相同的离子核电荷数越大半径越小。C选项M2Y是离子化合物。
[答案]D
[考点分析]本题考查原子结构、元素的推断、元素周期律等知识。
4. (2009山东卷11).元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构,
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
[解析]碳元素在遇到不同的物质反应时,即可表现为得到电子,也可能表现为失去电子; C中H元素、Li元素不符合;第一主族的所有元素最外层都为一个电子,但是H元素与Na元素性质差异很大。
[答案]B
[考点分析]本题主要考查元素周期律的相关知识。
3.(2009广东卷1).我国稀土资源丰富。下列有关稀土元素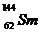 与
与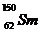 的说法正确的是
的说法正确的是
A. 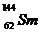 与
与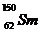 互为同位素
互为同位素
B. 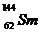 与
与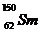 的质量数相同
的质量数相同
C. 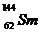 与
与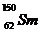 是同一种核素
是同一种核素
D. 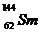 与
与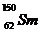 的核外电子数和中子数均为62
的核外电子数和中子数均为62
[解析]质子数相同,中子数不同的核素称为同位素,具有一定数目质子数和中子数的原子成为核素。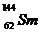 与
与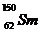 质量数不同,B错;
质量数不同,B错;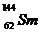 与
与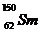 是不同核素,C错;
是不同核素,C错;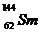 与
与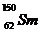 的中子数不同, D错。
的中子数不同, D错。
[答案]A
[考点分析]本题考查同位素和核素的相关概念和原子结构方面的基本计算。
2.(2009江苏高考化学8)X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是:
A.元素Y、Z、W具有相同电子层的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY> XmR
D.元素W、R的最高价氧化物的水化物都是强酸
[解析]根据题意判断出5种元素分别是: X:H、Y:O、Z:Na、W:Al、R:S;
A中的离子半径是依次减小的,所以错误;
X能与Y形成化合物H2O2 ,所以B错误;
Al最高价氧化物的水化物是Al(OH)3,属于两性氢氧化物,所以D错误;
[答案]C
[考点分析]本题考查原子结构、元素的推断、元素周期律等知识。
[典例精析]
1.(2009广东卷11).元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
[解析]由题目信息可推断出,X为Na ,Y为Cl,Z为O。同周期(第三周期中)X(Na)的金属性最强,A正确;同周期元素从左向右原子半径减小,原子半径X(Na)>Y(Cl),电子层结构相同的离子,离子半径随核电荷数的增加而减小,离子半径X(Na+)<Z(O2-),B错误;同族元素中(VIA族)Z(O)的氢化物稳定性最高,C正确;同周期(第三周期中)Y(Cl)的非金属性最强,则最高价含氧酸的酸性最强(HClO4),D正确。
[答案]B
[考点分析]本题考查元素周期律的相关知识如:金属性强弱、半径大小比较、氢化物的稳定性、最高价含氧酸的酸性。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com