
3、.某同学在实验室闻到类似碘酒的气味,寻“味”而去,发现实验台上棕色瓶内装有固体碘。据此不能说明的是( )A.碘易升华 B.分子在不断运到 C .分子间有间隙 D.分子可以再分
2、 硫离子的结构示意图如右图所示,与硫原子比较,二者( )
硫离子的结构示意图如右图所示,与硫原子比较,二者( )
A.核内质子数相同 B.核外电子数相同
C.化合价相同 D.化学性质相同
2、某元素原子结构示意图为; 则x = _________。根据元素原子结构
示意图不能直接获得的信息是________(填编号)。
①核电荷数 ②相对原子质量 ③电子层数 ④最外层电子数 ⑤ 元素的部分化学性质
[归纳]:分子,原子,离子都是构成物质的基本微粒,在化学变化中分子被分解成原子,原子重新组合成新的分子,或分解后的原子直接构成物质,或分解后的原子得失电子后形成离子,再结成离子化合物。所以说世界上的物质都是由分子,原子,离子三种微粒构成的。
练习1、(宁德市中考题)对于Mg2+和Mg两种粒子比较、下列说法不正确的是 ( )
A、它们的化学性质相同, B、它们都是构成物质的粒子,
C、它们的电子数相同, D、它们的质子数相同。
1.下面是五种粒子的结构示意图:

(1)图中粒子共表示 种元素。图中 (填序号)表示某稀有气体元素的原子结构示意图。
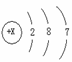 (2)图中表示的阳离子是 (用离子符号表示),表示的阴离子是 (用离子符号表示)。
(2)图中表示的阳离子是 (用离子符号表示),表示的阴离子是 (用离子符号表示)。
3、相对分子质量:等于构成分子的各原子的相对原子质量的总和。
例如:硝酸铵的化学式为NH4NO3求硝酸铵的相对分子质量。
解:相对原子质量:N一14、H一1、O一16则Mr=14×2+1×4+16×3 = 80
练习:求,KMnO4 、 (NH4)2SO4 、 Ca(OH)2、的相对分子质量。
三,离子:
1,定义:原子得失电子后形成带电的微粒叫离子.
[讲解]:要了解原子得失电子的过程必需掌握原子的结构,我们已经知道原子是由原子核和核外电子构成的。化学上用一种图形把原子结构形象地表示出来,这种图形我们把它叫做原子结构示意图。
2,原子结构示意图:(用图形来表示原子的结构叫原子结构示意图)
拓展视野:P70页
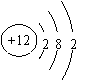
镁原子结构示意图:⑴圆圈表示原子核里面的数字表示质子数
⑵弧线表示电子层,上面的数字表示该层的电子数.
(注:原子最外层电子数必需达到8个才能稳定,小于4个容易失去变成阳离子,大于4个容易获得电子变成阴离子)
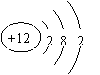 [讲解]原子得失电子后形成的离子分别带上负电荷和正电荷,我们把带正电荷的离子称为阳离子;把带负电荷的离子称为阴离子。阴阳离子相互吸引,最终形成离子化合物,这也就是我们把氯化钠叫做离子化合物的原因。
[讲解]原子得失电子后形成的离子分别带上负电荷和正电荷,我们把带正电荷的离子称为阳离子;把带负电荷的离子称为阴离子。阴阳离子相互吸引,最终形成离子化合物,这也就是我们把氯化钠叫做离子化合物的原因。
⒊ 原子与离子的区别:
原子:质子数=核外电子数 如:符号→Mg、名称→镁、结构→
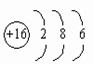
符号→S、 名称→硫、结构→
 离子:
离子:
⑴阳离子:质子数>核外电子数如:符号→Mg2+→ 名称:镁离子、结构→
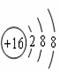
⑵阴离子:质子数﹤核外电子数 如:符号→S2-名称:硫离子。结构→
1,相对原子质量=原子质量/碳原子质量的1/12
例如:已知m(碳)=1.993X10-26Kg,,(m(碳)/12=1.993X10-26Kg/12= 1.66X10-27Kg),m(氧)=2.657X10-26Kg。求氧原子的相对原子质量?
解:氧的相对原子质量= 氧原子的质量/ 碳原子质量/12=1.993X10-26Kg/1.66X10-27Kg=16。例:已知铁原子的质量为M,碳原子的质量为N,求铁原子的相对原子质量是多少?
解:铁的相对原子质量=铁原子的质量/碳原子的质量/12=M/N/12=12M/N
讲解:相对原子质量大约可以等于质子数与中子数之和,
2. 相对原子质量 = 中子数 + 质子数
课堂练习:
1,铟原子的核电荷数为49,相对原子质量为92,中子数为-------( )
A, 141 B, 92 C,49 D,43。
2,氡原子相对原子质量为222,中子数为136,则氡原子核外电子数______质子数______.
3,铀原子相对原子质量为238,核电荷数为92,中子数与电子数之差为-----------( )
A,146 B,92 C,136 D,54
10. 你最好乘火车。
You'd _______ ______ a train.
[练习答案]
9. 他从小就对数学感兴趣。
He became ________ in maths when he was ________.
8. 他和我都不是老师。
______ he _______ I am a teacher.
7. 直到妈妈回来时,他才完成作业。
He ______ finish his homework _______ his mother came back.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com