
1、战国时期百家争鸣中,诸子百家的观点实质上代表
A、统治阶级的利益 B、不同阶级阶层的利益
C、知识分子的不同认识 D、新兴地主阶级的利益
8.某兴趣小组为探究温度、压强对可逆反应A(g)+B(g)
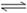 C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的量浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各物质的量浓度为[浓度2]、[浓度3]。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的量浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各物质的量浓度为[浓度2]、[浓度3]。
|
|
A |
B |
C |
|
浓度1 |
0.05mol·L-1 |
amol·L-1 |
0.05mol·L-1 |
|
浓度2 |
0.078mol·L-1 |
0.078mol·L-1 |
0.122mol·L-1 |
|
浓度3 |
0.06mol·L-1 |
0.06mol·L-1 |
0.04mol·L-1 |
|
浓度4 |
0.07mol·L-1 |
0.07mol·L-1 |
0.098mol·L-1 |
请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是
A.由[浓度3]与[浓度1]的比较,可判断出正反应是放热反应
B.由[浓度2]与[浓度1]的比较,可判断平衡移动的原因是升高温度
C.[浓度1]中a=0.05mol·L-1
D.该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4]。与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差。
7.自然界中存在一种尖晶石,化学式可表示为MgAl2O4,它透明色美,可作为宝石。已知该尖晶石中混有Fe2O3。取一定量样品5.4g,恰好完全溶解在一定浓度100 mL盐酸溶液中,盐酸浓度可能是
A.2.8 mol·L-1 B.3.8 mol·L-1 C.4.3 mol·L-1 D.4.9 mol·L-1
6.下列说法中正确的是( )
A.同时含有分子和离子的电解质溶液,一定是弱电解质溶液
B.pH=3的盐酸中,其c(H+)是pH=1的盐酸中的3倍
C.0.1 mol/L KOH溶液和0.1 mol/L 氨水中,其c(OH-)相等
D.室温时,pH=3的硫酸和pH=11的氨水等体积混合,混合溶液的pH>7
5.有四种金属A、B、C、D,它们与浓HNO3反应时,只有A不反应,把这四种混合物加入盐酸,其中B、C溶解,过滤后,在滤液中加入过量的NaOH溶液,可得到C离子的沉淀,则这四种金属的活动性强弱的顺序可能是( )
A.B>A>D>C B.A>B>C>D C.C>B>D>A D.D>C>B>A
4.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢 气的两种反应原理是:
①CH3OH(g)+H2O(g) ==== CO2(g)+3H2(g);DH1 = + 49.0 kJ·mol-1
 ②CH3OH(g)+1/2O2(g) = CO2(g)+2H2(g);DH2=-192.9 kJ·mol-1
②CH3OH(g)+1/2O2(g) = CO2(g)+2H2(g);DH2=-192.9 kJ·mol-1
下列说法正确的是( )
A.CH3OH的燃烧热DH =-192.9 kJ·mol-1
B.反应②中的能量变化如图所示,则DH2=E1-E3
C.H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收能量
D.根据②推知:在25℃,101kPa时,1molCH3OH(g)燃烧生成CO2和H2O放出热量应大于192.9kJ
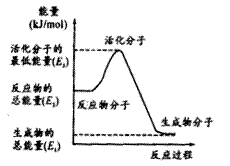
3.
 右图为一恒压容器。在恒定温度下,将1molN2和3molH2混合后由A口快速充入容器,封闭A。反应N2+3H2
右图为一恒压容器。在恒定温度下,将1molN2和3molH2混合后由A口快速充入容器,封闭A。反应N2+3H2 2NH3在t1时刻达到平衡;t2时刻再从A口快速充入一定量NH3,封闭A;t3时刻重新达平衡至t4。在0→t4时间内混合气中NH3的体积分数(纵坐标)随时间(横坐标)变化的曲线正确的是( )
2NH3在t1时刻达到平衡;t2时刻再从A口快速充入一定量NH3,封闭A;t3时刻重新达平衡至t4。在0→t4时间内混合气中NH3的体积分数(纵坐标)随时间(横坐标)变化的曲线正确的是( )
2.A、B、C三种物质,每个分子中都含有18个电子且B、C均为两种元素组成的化合物。其中A的分子属于非极性分子,且只有非极性键;B的分子由四个原子构成,既有极性键也有非极性键;C的分子由八个原子构成。A、B、C在常温下状态分别是( )
A.固、液、液 B.气、液、气 C.液、液、气 D.气、气、气
1.下列有关叙述正确的是( )
A.塑料袋、废纸、旧橡胶制品都属于有机物
B.空气、冰醋酸、盐酸都是混合物
C.氯化钠电离成钠离子和氯离子这一过程是化学变化
D.只含一种元素的物质是单质
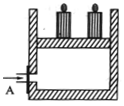
30.(16分)资料显示不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
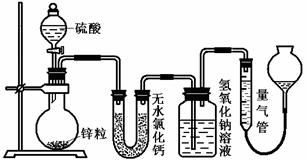
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ (选填:200,400,500) mL 。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:________________________________________
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到VmL气体,则有:ag/65g·mol-1=bg/64g·mol-1+V mL / 22400 mL·mol-1,依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。
(5) 反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
、 、
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com