
●教学说明
由于本章内容较少,课时安排少,学完第四节蛋白质内容之后,学生对第一节所学内容仍记忆犹新,因此,本章的复习课主要以学生自己总结为主,然后结合典型例题加深巩固。
3.25℃时,在物质的量浓度均为1mol/ L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,c(NH4+)分别为a、b、c(单位为mol/ L)。下列判断正确的是 ( )
A. a>b>c B. b>a>c C. a>c>b D. c>a>b
2.在CH3COONa溶液中各离子的浓度由大到小排列顺序正确的是 ( )
a+)﹥c(CH3COO-)﹥c(OH-)﹥c(H+) B.c(CH3COO-)﹥c(Na+)﹥c(OH-)﹥c(H+)
a+)﹥c(CH3COO-)﹥c(H+)﹥c(OH-) a+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
(1)电荷守恒:电解质溶液中无论含多少种离子,但溶液总是呈电中性的。即整个溶液中_____ _ __所带的负电荷总数一定等于__ _ __所带正电荷总数。如在NH4Cl溶液中有__________ ___________
(2)原子守恒(物料守恒):电解质溶液中尽管有些离子水解、电离等原因发生改变,但某原子总数是保持不变的。如NH4Cl中存在________ ____________.
[思考与交流]写出下列溶液中的各种守恒关系:
①0.1mol/LNa2CO3溶液中:电荷守恒:________ ____ 物料守恒:_____ ___________.
②0.1mol/L H2S溶液中电荷守恒__________ _________物料守恒_____ ____________
[反馈练习]
1.在一定条件下发生下列反应,其中属于盐类水解反应的是 ( )
 A.NH4+
+2H2O
A.NH4+
+2H2O 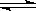 NH3·H2O
+ H3O+ B.HCO3-
+ H2O
NH3·H2O
+ H3O+ B.HCO3-
+ H2O 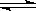 H3O+
+ CO32-
H3O+
+ CO32-
C.HS-+H+=== H2S
D.Cl2+H2O 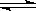 H++Cl-+HClO
H++Cl-+HClO
1判断溶液的酸碱性:
(1)将0.1mol/L的下列溶液按PH由小到大的顺序排列①Na2CO3②NaHCO3 ③NaOH ④NaNO3 ⑤CH3COOH ⑥NaHSO4 ⑦NH4Cl_________________ ______
(2)酸式盐溶液的酸碱性:酸性NaHSO3 NaH2PO4 碱性NaHCO3 NaHS Na2HPO4
2判断溶液中离子浓度的大小:
(1)CH3COONa溶液中离子浓度大小顺序为________________________
 (2)(NH4)2SO4溶液中离子浓度大小顺序为__________________
(2)(NH4)2SO4溶液中离子浓度大小顺序为__________________
(3)Na2CO3溶液中离子浓度大小顺序为__________________________
 3配制盐溶液时,加酸或碱抑制水解:
3配制盐溶液时,加酸或碱抑制水解:
为了防止配制FeCl3溶液时可能浑浊,应向溶液中加入 抑制 水解。
4把盐溶液蒸干制取无水盐晶体:把下列盐溶液蒸干得到何种物质:
AlCl3____ ___ Al2(SO4)3 _____ ___ FeCl3______ __
Na2CO3______ _ CuSO4 __ ___
5判断溶液中的离子能否共存:主要掌握Al3+(Fe3+)与HCO3-、CO32- ,AlO2-、S2-不共存。
6某些活泼金属与盐溶液的反应:Mg粉投入NH4Cl溶液中反应的离子方程式:
___________________________________ ___________
7试剂存放:盛放Na2CO3溶液的试剂瓶不能用玻璃塞,原因是
_____________________________________________ _______
盛放NH4F溶液不能用玻璃瓶,是因为_______________________________________
8日常生活中的应用:
(1)泡沫灭火器原理(方程式)_____________ __________________
(2)为什么,KAl(SO4)2 ,Fe2(SO4)3、Al2(SO4)3等盐可用做净水剂
_______________________ ___________
(3)草木灰为什么不能和铵态氮肥混合使用
______________ _________________________.
2.为什么热的纯碱溶液去污效果好?
第3课时
[课标要求]1进一步巩固盐类水解的实质的理解
2掌握盐类水解实质并解释一些日常生活中的现象
[学习重点]盐类水解实质并解释一些日常生活中的现象
[学习难点]盐类水解方程式的书写和分析
[学习过程]
[情景创设]
应用平衡移动原理分析醋酸钠溶液水解平衡的移动情况,如下表所示:
|
条件变化 |
C(CH3COO-) |
C(CH3COOH) |
C(OH-) |
C(H+) |
PH |
水解程度 |
|
升高温度 |
|
|
|
|
|
|
|
加水 |
|
|
|
|
|
|
|
加醋酸 |
|
|
|
|
|
|
|
加醋酸钠 |
|
|
|
|
|
|
|
加盐酸 |
|
|
|
|
|
|
|
加NaOH |
|
|
|
|
|
|
1.能使Na2CO3溶液中Na+与CO32- 更接近2:1的措施是 ( )
A 加水 B 加Na2CO3粉末 C 加KOH固体 D 加热
3.影响盐类水解的因素
[科学探究]通过实验探究促进或抑制FeCl3水解的条件,了解影响盐类水解程度的因素。
写出FeCl3水解的化学方程式 ,设计实验完成下表
|
影响因素 |
实验操作 |
现象 |
平衡移动方向 |
Fe3+的水解程度 |
PH |
|
浓度 |
加FeCl3 |
|
|
|
|
|
加水 |
|
|
|
|
|
|
溶液的 酸碱度 |
加HCl |
|
|
|
|
|
加少量的NaOH |
|
|
|
|
|
|
加NaHCO3 |
|
|
|
|
|
|
加Na2CO3 |
|
|
|
|
|
|
温度 |
温度升高 |
|
|
|
|
[归纳总结]影响盐类水解的因素
 (1)盐类本身的性质:这是影响盐类水解的主要因素。组成盐的酸或碱越弱,其水解程
(1)盐类本身的性质:这是影响盐类水解的主要因素。组成盐的酸或碱越弱,其水解程
度 ,溶液的碱性或酸性
(2)温度:盐的水解是____ _反应。因此升高温度其水解程度_____.
 (3)浓度:盐的浓度越小,其水解程度越______.
(3)浓度:盐的浓度越小,其水解程度越______.
(4)溶液的酸碱性:控制溶液的酸碱性,可以促进或抑制盐的水解。如Na2CO3溶液中加碱可以____ _水解。加酸可以___ __水解。
[反馈练习]
4.盐类水解的类型和规律
(1)强碱弱酸盐水解,溶液呈___ __性,PH____7。如CH3COONa等。
原因是_______与水电离出的_ __结合生成_______,从而使溶液中c(H+) ,c(OH-) ,从而使c(OH-) c(H+),溶液呈 性。
写出下列盐水解的离子方程式:
CH3COONa
 K2CO3
K2CO3
(2)强酸弱碱盐水解,溶液呈___ __性,PH__ __7。如NH4Cl等。
 原因是_______与水电离出的_
__结合生成_____ 。从而使溶液中c(H+) ,c(OH-) ,从而使c(OH-)
c(H+),溶液呈
性。
原因是_______与水电离出的_
__结合生成_____ 。从而使溶液中c(H+) ,c(OH-) ,从而使c(OH-)
c(H+),溶液呈
性。
写出下列盐水解的离子方程式:
FeCl3
(NH4))2SO4
(3)强酸强碱盐不发生水解,溶液呈__ ___性,PH___ _7。
(4)弱酸弱碱盐强烈水解,溶液的酸碱性取决于形成盐的酸和碱的相对强弱。
(5)弱酸酸式盐的水解。溶液液的酸碱性取决于酸式根离子的电离程度和水解程度的相对大小。若电离程度___ __水解程度,则溶液呈酸性。如NaHSO3、NaH2PO4等。若电离程度___ ___水解程度,则溶液呈碱性。如NaHCO3Na2HPO4等
水解规律:“谁弱谁水解,无弱不水解,都弱双水解,谁强显谁性,都强显中性”。
[思考与交流] (1)用____ ___可鉴别NH4Cl、NaCl、CH3COONa三种溶液。
(2)相同浓度的Na2CO3、NaHCO3、CH3COONa溶液的PH大小顺序为___________________
(3)相同浓度拓NaX、NaY、NaZ溶液的PH值分别等于8、9、10,则对应三种酸的酸性强弱顺序为________________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com