
16.[江苏省启东中学2009届高三阶段调研测 ](8分)盐R的化学式为XmYnZp(X、Y、Z为三种不同离子),其组成元素均为短周期元素,取两份等质量等浓度R的水溶液进行如下实验:
 Ⅰ.取一份R的水溶液与过量的Ba(OH)2
Ⅰ.取一份R的水溶液与过量的Ba(OH)2
溶液反应,反应过程中生成白色沉淀,沉
淀量先增加后减少,最终剩余沉淀甲
15. [江苏省启东中学2009届高三阶段调研测 ](8分)有一元色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示。请回答:
[江苏省启东中学2009届高三阶段调研测 ](8分)有一元色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示。请回答:
(1)溶液中肯定没有_____________离子。
(2)溶液中离子的物质的量之比为_________________________________。
(3)①淡黄色粉末与水反应的化学方程式为__________________________。
②沉淀部分减少时的离子方程式为____________________________________。
答案.(8分)(1)Fe3+、Cu2+ (2分) (2)Mg2+︰NH4+︰Al3+=1︰1︰1(2分)
(3)①2Na2O2+2H2O = 4NaOH+O2↑(2分) ②Al(OH)3+OH- = AlO2-+2H2O (2分)
13.[江苏省南通市2009届高三期中检测11月]50g含有1.17g氯化钠和0.84g氟化钠的溶液中加入过量的硝酸银溶液,充分反应搅拌、静止、过滤、洗涤、干燥得到2.87g固体,由此得出的结论是 [ D]
A.氯离子只有一部分参加反应 B.氟离子只有一部分参加反应
C.氟化银难溶于水 D.氟化钠和硝酸银在溶液中无沉淀生成
14[江苏省南通市2009届高三期中检测11月].NA表示阿伏加德罗常数的值,下列说法正确的是[ D]
A.铁、铜和稀硫酸构成原电池,当转移NA个电子时,产生的气体体积为11.2L
B.通常状况下将0.5molHI气体和0.5molCl2混合后,气体的分子数为NA
C.标准状况下0.5NA个Br2所占的体积约为11.2L
D.53gNa2C03固体含有的离子数为1.5NA
12.[江苏省南通市2009届高三期中检测11月]在25℃,101Kpa下由HCHO(g)、H2和CO组成的混合气体共6.72g,其相对氢气的密度为14将该气体与2.24L氧气(标准状况)充分反应后的产物通过足量的Na202粉末,使Na202粉末增重的质量为[B ]
A.等于6.72g B.小于6.72g C.大于6.72g D.无法计算
11.[江苏省南通市2009届高三期中检测11月] (6分)已知固体混合物A由NaHC03、KHC03、MgC3、CaC03四种物质中的两种混合而成,通过计算和推理回答下列问题:
(1)取A与足量的盐酸反应
①若n(A)为定值,生成气体的量即为定值,则A的组成最多可能有 种。
②若m(A)为定值,生成气体的量即为定值,则A的可能组成是 ; ; 。(可以不填满,也可以补充)
(2)若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清的石灰水生成的沉淀均为10.Og,则n(A)= mol.
答案.(1)①6 ②MgCO3,NaHC03;KHC03,CaC03
(2)O.200
10.[江苏省南通市2009届高三期中检测11月] (6分)气体A由C、H、F、S中的三种元素组成。将标准状况下1.12L气体A在过量的02中完全燃烧,后恢复到原状态,放出25kJ的热量。已知气态生成物全部被过量的Ca(OH)2溶液吸收,可以得到6.95g沉淀。再取相同条件下的1.12L气体A装入一个薄膜袋里,袋和气体的总质量为2.20g。(已知CaS03、CaF2、CaC03)难溶于水)
(1)根据上述数据估算,A的相对分子质量不会大于 。
(2)通过计算、分析可确定A的化学式为 。
(3)薄膜袋的质量为 。
(4)写出该条件下A在02中燃烧的热化学方程式: 。
答案.(1)44
(2)CH3F
(3)O.50g
(4)2CH3F(g)+302(g)→2C02(g)+2HF(g)+2H20(l); △H=一1000kJ·mol一1
9.[江苏省南通市2009届高三期中检测11月] (6分)将1.05g铝和过氧化钠的混合物放入一定量的水中,充分反应后固体无剩余。再向其中加入50mL 1 mol·L一1的盐酸,可恰好使反应过程中产生的沉淀消失。求原混合物中铝、过氧化钠各多少克?
.解:有关反应为:2Na2O2+2H2O=4NaOH+02↑
2Al+2NaOH+2H2O=2NaAl02+3H2↑
NaAlO2+HCl+H20=Al(OH)3↓+NaCl
A1(OH)3+3HCl3+3HCl=AlCl3+3H20
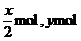 最终溶液中所含溶质为NaCl、AlCl3,
最终溶液中所含溶质为NaCl、AlCl3,
设NaCl、AlCl3的物质的量分别为x mol,ymol,则Na202、Al的物质的量分别为 ,依题意有:
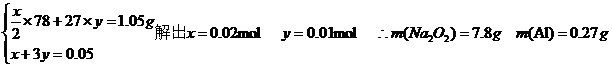
8.[江苏省南通中学2008学年度第一学期期末复习高三化学1月 ]某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
(1) 该结晶水合物中含有的两种阳离子是________和________,阴离子是_________。
 (2)试通过计算确定该结晶水合物的化学式。
(2)试通过计算确定该结晶水合物的化学式。
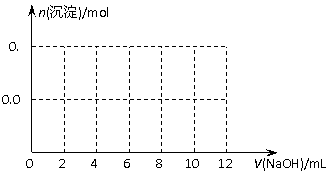
(3)假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol/L,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
答案(1)NH4+ Al3+ SO42- (3分)
(2)n(SO42-)=0.2mol
n(NH4+)=0.1 mol n(Al3+)=0.1 mol,
n(H2O)=1.2mol
化学式为NH4 Al (SO4)2·12H2O
[或(NH4)2SO4·Al2(SO4)3·24H2O] (5分)
(3)(2分)
7.[江苏省南通中学2008学年度第一学期期末复习高三化学 ]钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物。
⑴钾和硝酸钾反应可制得K2O(10K+2KNO3→6K2O+N2),39.0g钾与10.1g硝酸钾充分反应生成K2O的质量为 g。
⑵某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为 。
⑶超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2→2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2L(标准状况)CO2和KO2反应后,气体体积变为18.8L (标准状况),计算反应消耗的KO2的质量。
⑷KO2加热至600℃部分分解得到产物A。6.30g产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),试确定产物A中钾氧两种原子个数之比。如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比。
答案、.⑴28.2 (2分)。 ⑵96.25%(2分)。 ⑶71 g(2分)。
⑷n(K):n(O)=2:3(2分);n(KO2):n(K2O2) = 2:1(1分),n(KO2):n(K2O) = 4:1(1分)。
6.[江苏省南通中学2008学年度第一学期期末复习高三化学 ]蛋白质主要由氨基酸组成,平均含氮量为16%左右。通用的蛋白质测试方法--凯式定氮法--是通过测出含氮量来估算蛋白质含量,主要原理为:将食品与硫酸和催化剂一起加热,使蛋白质分解,分解的氨用硼酸吸收后再以盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
已知:1mol氨基能产生1mol氨气;
2NH3+4H3BO3→(NH4)2B4O7+5H2O;
(NH4)2B4O7+2HCl+5H2O→2NH4Cl+4H3BO3
某兴趣小组进行了如下实验:
步骤I 称取样品1.500g。
步骤II (略)
步骤Ⅲ 共得到1L吸收了氨的硼酸样品溶液,从中移取10.00mL于250mL锥形瓶中,加入少量水和指示剂,用0.010mol/L的盐酸滴定至终点。
⑴根据步骤Ⅲ填空:
①滴定管用蒸馏水洗涤后,直接加入盐酸进行滴定,则测得样品中氮的质量分数
(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去盐酸的体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
⑵滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积(mL) |
标准溶液的体积 |
|
|
初读数(mL) |
末读数(mL) |
||
|
1 |
10.00 |
0.00 |
14.90 |
|
2 |
10.00 |
0.10 |
15.05 |
|
3 |
10.00 |
0.50 |
17.00 |
该样品中氮的质量分数为 。
答案⑴①偏高(2分)。 ②无影响(2分)。 ③锥形瓶内溶液颜色的变化(2分)
⑵13.93%(3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com