
1.[2010·上海文数]“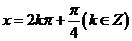 ”是“
”是“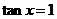 ”成立的( )
”成立的( )
A.充分不必要条件 B.必要不充分条件.
C.充分条件 D.既不充分也不必要条件.
[答案]A
[解析]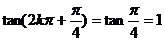 ,所以充分;但反之不成立,如
,所以充分;但反之不成立,如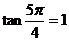 .
.
23.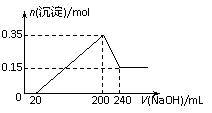 [江苏省启东中学2009届高三阶段调研测 ]将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如右图所示。.则下列说法不正确的是[ D ]
[江苏省启东中学2009届高三阶段调研测 ]将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如右图所示。.则下列说法不正确的是[ D ]
A.镁和铝的总质量为9 g
B.最初20 mLNaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
22.[江苏省启东中学2009届高三阶段调研测 ]设NA表示阿伏加德罗常数,下列说法中不正确的是[ B ]
A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D.125gCuSO4·5H2O晶体中含有0.5NA个Cu2+
21.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为[ B ]
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
1.
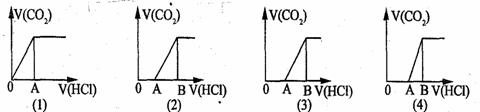
A.M中只有一种溶质的有(1)和(3) B.M中有两种溶质的有(2)和(4)
C.2)图显示M中c(NaHCO3)>c(Na2CO3)
D.(4)图显示M中c(NaHCO3)>c(Na2CO3)
20.[江苏省启东中学2009届高三阶段调研测 ]向某NaOH溶液中通人CO2气体后得溶液M,因CO2通人量的不同,溶液M的组成也不同。若向M中逐滴加人盐酸,产生的气体体积V(CO2)与加人盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别有OA<AB,OA=AB,OA>AB,则下列分析与判断不正确的是(不计CO2的溶解)[ CD ]

19.[江苏省启东中学2009届高三阶段调研测 ]今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是[ AC ]
A K+一定存在 B 100mL溶液中含0.01mol CO32-
C Cl-可能存在 D Ba2+一定不存在,Mg2+可能存在
18.[江苏省启东中学2009届高三阶段调研测 ](10分)(1)某一反应体系中有反应物和生成物共5种物质: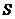 、
、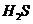 、
、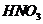 、
、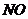 、
、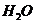 。该反应中还原产物是______;若反应过程中转移了0.3
。该反应中还原产物是______;若反应过程中转移了0.3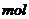 电子,则氧化产物的质量是______
电子,则氧化产物的质量是______ 。
。
(2)将a mol Cl2 通入含b mol FeBr2的溶液中,当0< a / b≤1/2 时,反应的离子方程式为:2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ,写出另2个可能发生的离子方程式。
① 当 a / b =1时____________________________________________;
② 当a / b≥3/2时____________________________________________。
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3 +H2O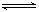 Al(OH)4- + H+ ②NH3+H2O
Al(OH)4- + H+ ②NH3+H2O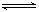 NH4+ +
OH_
NH4+ +
OH_
(A)已知B(OH)3是一元弱酸,试写出其电离方程式
_______________________________________________
(B)N2H4是二元弱碱,试写出其第二步电离方程式
_______________________________________________
答案.(1)NO 4.8g (2) ①2Cl2 + 2Fe2+ + 2Br- = 4Cl- + 2Fe3+ + Br2
②3Cl2 + 2Fe2+ + 4Br- =2Fe3+ + 2Br2 + 6Cl-
(3)B(OH)3+H2O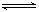 B(OH)4- + H+ N2H5+
+H2O
B(OH)4- + H+ N2H5+
+H2O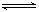 N2H62+ + OH_
N2H62+ + OH_
17.[江苏省启东中学2009届高三阶段调研测 ](8分)2.80g铁与100mL稀硝酸混合后充分反应,产生气体为NO,反应后铁、硝酸均无剩余。向反应后的溶液中加入100mL0.2 mol·L-1的碘化钾溶液,恰好将溶液中的Fe3+全部还原。求原硝酸溶液的物质的量浓度。
答案.(8分)n[Fe(NO3)3]=n(I-)= 0.2 mol·L-1 ×0.100L=0.020mol (1分)
n[Fe(NO3)2]=n(Fe)-n[Fe(NO3)3]=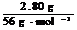 -0.020mol=0.030mol (1分)
-0.020mol=0.030mol (1分)
根据电子守衡:n[Fe(NO3)3]×3+ n[Fe(NO3)2]×2=n(NO)×3
即:0.020mol×3+0.030mol×2= n(NO)×3 ∴ n(NO)=0.040mol(2分)
根据氮元素守衡:n(HNO3)= n(NO)+ n[Fe(NO3)3]×3+ n[Fe(NO3)2]×2
=0.040mol+0.020mol×3+0.030mol×2=0.16mol(2分)
c(HNO3)=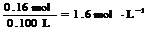 (2分)
(2分)
4.66g,且甲不溶于稀盐酸;
Ⅱ.取另一份R的水溶液与过量的NaOH
溶液混合加热,生成具有刺激性气味的气
体乙0.224L(标准状况),乙能使湿润的
红色石蕊试纸变蓝。据此回答:
(1)写出R和甲的化学式:R ;甲 。
(2)另取500mL R的水溶液,向其中逐滴加入NaOH溶液,所得沉淀与加入的NaOH的物质的量关系如图所示。则:
①B点处溶液中离子浓度从大到小的顺序是 。
②R溶液的物质的量浓度为 。
③BC段表示的含义是 。
④CD段表示的含义是 。
答案.(1)NH4Al(SO4)2(1分);BaSO4(1分)
(2)c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-)(2分);2mol/L(2分)
NH4+与OH-生成NH3·H2O(1分)
Al(OH)3与NaOH反应,沉淀逐渐溶解(1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com