
24. (17分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)一氧化碳在高温下与水蒸气反应的方程式为:CO+H2O=CO2+H2。已知部分物质燃烧的热化学方程式如下: 2H2 (g) + O2(g) = 2H2O(l);△H=-571.6kJ·mol-1
2CO (g) + O2(g) = 2CO2 (g) ;△H=-566kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CO和水蒸气在高温催化剂下反应的热化学方程式 。
(3)在25℃下,向浓度为0.1 mol·L-1的AlCl3溶液中逐滴加入氨水,生成该沉淀的离子方程式为______________________________。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式 。
(5)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=1的H2SO4溶液VaL与pH=11的NaOH溶液VbL混合,若所得混合液为中性,则
Va︰Vb= 。
(6)在25℃下,将a mol·L-1的氨水 与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);
与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);
23.(15分)甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题:
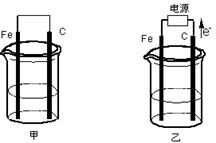
(1)若甲乙两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的 棒;乙池中的
 棒。
棒。
②在乙池中阳极的电极反应式是 。
(2)若甲乙两池中均盛放饱和NaCl溶液。
①写出甲池中正极的电极反应式 。
乙池中发生反应的离子方程式
②若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则此时溶液的pH= 。(不考虑电解产物的相互反应)
22.(14分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
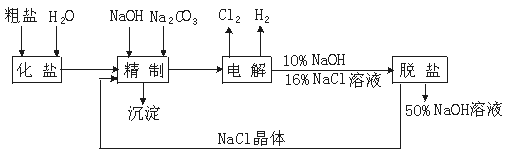
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的方程式为___________。与电源负极相连的电极附近溶液pH___________。(填“不变”“升高”或“降低”)
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为 , 。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该试剂可以是___________。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为___________
a.先加NaOH,后加Na2CO3,再加氯化钡
b.先加NaOH,后加氯化钡,再加Na2CO3
c.先加氯化钡,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过、蒸发、冷却___________(填写操作名称)除去NaCl。
21.(6分)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
2SO2(g)+O2(g)
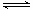 2 SO3(g);ΔH=196.6KJ/mol
2 SO3(g);ΔH=196.6KJ/mol
(1)该反应在__________(设备)中进行,这种生产硫酸的方法叫做________。
(2)为什么实际生产中,选定400℃-500℃作为操作温度?
答:
(3)为什么二氧化硫接触氧化在常压下进行?
答:
。
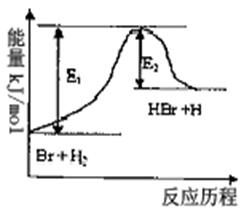
20.参照反应Br+H2 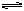 HBr+H的能量对反应历程的示意图,下列叙述中正确的是 ( )
HBr+H的能量对反应历程的示意图,下列叙述中正确的是 ( )
A.该反应的△H = +(E1-E2) kJ/mol
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量高于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
第Ⅱ卷(非选择题,共60分)
19.用NA表示阿伏伽德罗常数,下列说法中正确的是 ( ) 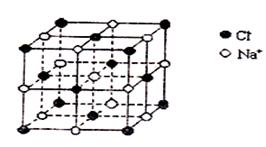
A.1L 1mol/L的醋酸溶液中离子总数为2NA
B. 0.4molNaCl晶体中含有上图所示的结构单元的数目为0.1NA
 C.0.5mol熔融的KHSO4中含有阳离子的数目为NA
C.0.5mol熔融的KHSO4中含有阳离子的数目为NA
D.标准状况下,22.4LCH2Cl2和CHCl3 的混合物所含有分子数目为NA
18.若用铅蓄电池作电源电解饱和食盐水制取 Cl2 ,且已知铅蓄电池放电时发生如下反应:负极:
Pb +SO42- =PbSO4 +2e-;正极PbO2 +4H+ +SO42- +2e- =PbSO4 +2H2O。今若制得Cl2 0.050 mol ,这时电池内消耗H2SO4 的物质的量至少是 ( )
A. 0.025 mol B. 0.050 mol C.0.10 mol D.0.20 mol
17.水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是 ( )
A.水由液态变为玻璃态,体积缩小 B.水由液态变为玻璃态,体积膨胀
C. 玻璃态是水的一种特殊状态 D.玻璃态水是分子晶体
16.如右图所示,X、Y、Q、W都是惰性电极,将电源接通后,
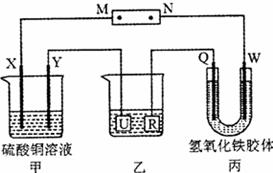 W极附近颜色逐渐加深。下列说法中不正确的是( )
W极附近颜色逐渐加深。下列说法中不正确的是( )
A.电源的M极为负极
B.甲装置中溶液的PH减小
C.甲装置的两个电极上都有单质生成且物质的量之比为1:1
D.欲用乙装置给铜镀银,U极应该是Ag,电镀液选择AgNO3溶液
15.下图装置用于实验室发生、干燥和收集气体(尾气处理装置已略去)。能利用这套装置进行的实验是 ( )

A、电石与食盐水制C2H2 B、块状大理石与稀硫酸制CO2
C、铜屑与浓硝酸制NO2 D、二氧化锰与浓盐酸制Cl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com