
2.在100mL0.10mol/L的AgNO3溶液中加入100mL溶有2.08g BaCl2的溶液,再加入
100mL溶有0.010molCuSO4·5H2O的溶液,充分反应.下列说法中正确的是
A.最终得到白色沉淀和无色溶液
B、最终得到白色沉淀是等物质的量的两种化合物的混合物
C.在最终的溶液中n(Cl-)=0.02mol
D.在最终的溶液中c(Cu2+)=0.01mol/L
1.在化学学科上经常使用下列物理量,其中跟阿伏加德罗常数无关的物理量是
A、键长 B.摩尔质量 C.物质的量 D.气体摩尔体积
8.如果将相对原子质量的标准改变(如将C-12改为C-24),则阿伏加德罗常数、摩尔质量、气体摩尔体积、物质的量等将如何改变?
[强化训练]
7.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下
体积相等时,反应中消耗的HCl和NaOH物质的量之比为
A.1:1 B.2:1 C、3:1 D.1:3
6.以石墨作电极电解氯化铜的溶液,电流强度为aA,时间t min后阴极增重Wg,
在阳极得VL纯净气体(标准状况),则计算阿伏加德罗常数的列式是
(1个电子的电量为q,铜的原子量为M)
A.64at/(2qw) B.672at/(Vq) C.30Mat/(wq) D.无法列式
5.下列说法正确的是:
A.标况下1摩任何气体所占体积一定是22.4升
B.非标准状况下,1摩H2所占体积一定不是22.4L
C.标况下,1mol水蒸气所占体积约为22.4L D.标况下1molNO2气体所占体积为22.4L
4.(2001年京、皖、蒙春季)氯的原子序数是17,35Cl是氯的一种同位素。
下列说法中正确的是:
A.35Cl原子所含的质子数是18 B、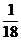 mol的1H35Cl分子所含的中子数约为6.02×1023
mol的1H35Cl分子所含的中子数约为6.02×1023
C.3.5g的35Cl2气体的体积是2.24L D、35Cl2气体的摩尔质量为70g/mol
3.设NA代表阿伏加德罗常数,下列说法中正确的是
A.2L 1mol/L(NH4)2SO4溶液中含2NA个NH4+
B.SiO2晶体中,与每1molSi原子结合形成共价键的O原子数为4NA
C.在标准状况下,1L辛烷完全燃烧,可产生8NA /22.4L二氧化碳
D.常温常压下,1mol氖气中含有NA个氖原子
2.(2001年上海)设NA为阿伏加德罗常数,下列说法不正确的是:
A、标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
B.18g水中含有的电子数为10NA
C.46gNO2和46gN2O4含有的原子数均为3NA
D.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
微粒数
NA ÷
× NA
 ÷摩尔质量
22.4L·mol-1÷
÷摩尔质量
22.4L·mol-1÷


 质量
物质的量
体积[气体体积(标准状况)]
质量
物质的量
体积[气体体积(标准状况)]
摩尔质量× (mol) ×22.4L·mol-1
÷ 溶液
溶液 体积
体积 ×
浓 度[物质的量浓度(mol/L)]
记忆方法:上微粒、下浓度,质量、体积分左右,中间就是摩尔(数)
向下、向内都用除 反之相乘得各数
注意点:
①一个中心:必须以物质的量为中心
②两个前提:在应用Vm=22.4L·mol-1时,一定要有“标准状况”和“气体状态”为两个前提。
③三个条件:★直接构成物质的粒子与间接构成物质的粒子(原子、电子等)间的关系;★摩尔质量与相对分子质量间的关系;
★“强、弱、非”电解质与溶质粒子(分子、或离子)数间的关系。
④四个无关:★物质的量、质量、粒子数的多少与温度、压强的高低无关
★物质的量浓度的大小与所取溶液的体积多少无关
(但溶质粒子数的多少与溶液体积有关)
⑤状态问题:水在标准状况下为液态或固态;SO3在标准状况下为固态,常温常压下为液态;碳原子数大于4的烃,在标准状况下为液态或固态。
⑥特别物质的摩尔质量:D2O、T2O、18O2等
⑦某些物质分子中的原子个数:Ne、O3、白磷等。
⑧一些物质中的化学键数目:SiO2、Si、CH4、P4、CO2等。
⑨某些离子或原子团在水溶液中发生水解反应,使离子数目减少
⑩较复杂的反应中,转移电子数的计算:Na2O2+H2O、Cl2+NaOH、电解AgNO3溶液等。
[典型例题]
1.如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积
是(式中NA代表阿伏加德罗常数)
A.22.4bc/(aNA)L B.22.4ab/(cNA)L C.22.4ac/(bNA)L D.22.4b/(acNA)L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com