
5. Don’t hesitate any more. You have to ____a choice.
A. take B. receive C. give D. make
4. –Dad, I’ve finished my assignment.
--Good, and ___ you play or watch TV, you mustn’t disturb me.
A. whenever B. whether C. whatever D. no matter
3. ____ I know the money is safe, I shall not worry about it.
A. Even though B. Unless C. As long as D. While
3. ____I can see, there is only one possible way to keep away from the danger.
A. As long as B. As far as C. Just as D. Even if
2. Sunglasses are important for children in summer_____ eye protection is necessary in sunny weather.
A. because B. though C. unless D. if
1. ____as she is, she is kept so busy with her work for women’s rights that she fees anything but____.
A. Alone, alone B. Lonely, lonely C. Lonely, alone D. Alone, lonely
3.溶液pH的计算
(1)单一溶液的pH计算
①强酸溶液,如HnA,设浓度为c mol·L-1,
c(H+)=nc mol·L-1,pH=-lgc(H+)=-lgnc。
②强碱溶液,如 B(OH)n,设浓度为c mol·L-1,
c(H+)= mol·L-1,pH=-lgc(H+)=14+lgnc。
mol·L-1,pH=-lgc(H+)=14+lgnc。
(2)酸、碱混合pH计算
①两强酸混合c混(H+)=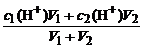
②两强碱混合c混(OH-)=
③强酸与强碱混合

(3)混合溶液pH的计算
①两种pH不同的强酸溶液混合时,要先求出混合后溶液中c(H+),再求其pH,当等体积混合时,可用速算法,即
ΔpH=1时,pH合=pH小+0.26
ΔpH≥2时,pH合=pH小+0.3
②两种强碱的稀溶液混合时,必须先求出混合后溶液中c(OH-),再利用KW换算成c(H+)求其pH。
当等体积混合时也可用速算法:
ΔpH=1时,pH合=pH大-0.26
ΔpH≥2时,pH合=pH大-0.3
(4)稀强酸与稀强碱溶液混合后pH的计算,要先根据H++OH-==== H2O计算出哪种物质过量,然后计算出过量的c(H+)或c(OH-),再求其pH。
(5)pH之和等于14的两种溶液以等体积相混合时,其混合溶液的pH的判断:
①若两者都是强电解质,则混合后pH=7。
②若酸为强酸,碱为弱碱,则混合后pH>7。
③若酸为弱酸,碱为强碱,则混合后pH<7。
(6)等物质的量浓度的一元酸、碱等体积混合后溶液的pH的判断:
①强酸和强碱混合,pH=7;②强酸和弱碱混合,pH<7;③弱酸和强碱混合,pH>7;④弱酸和弱碱混合,pH由强者决定;⑤未注明酸、碱强弱时,pH无法判断。
(7)等体积强酸(pH1)和强碱(pH2)混合:
①若溶液呈中性,二者pH之和为14。
②若溶液呈碱性,二者pH之和大于14。
③若溶液呈酸性,二者pH之和小于14。
试题枚举
[例1]体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于
A.9.0 B.9.5 C.10.5 D.11.0
解析: 方法一:盐酸与某一元强碱恰好完全反应时:n(OH-)=n(H+)。所以有c(OH-)×10V=c(H+)·V,c(OH-)= ,c(OH-)=
,c(OH-)=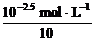 =10-3.5 mol·L-1
=10-3.5 mol·L-1
pH=-lgc(H+)=-lg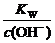 =-lg
=-lg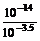 =-lg10-10.5=10.5。所以选择C选项。
=-lg10-10.5=10.5。所以选择C选项。
方法二:若1体积pH=2.5的盐酸和1体积某浓度的该一元强碱恰好完全反应,则酸中H+浓度等于碱中OH上标-浓度,两者的pH之和等于14,也就是碱的pH=11.5。将该溶液稀释10倍,就得到题中所用的强碱溶液,其pH减小1,等于10.5。
答案: C。
[例2] 25 ℃时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5 b。请填写下列空白。
(1)a值可否等于3(填“可”或“否”)_______,其理由是__________________。
(2)a值可否等于5(填“可”或“否”)_______,其理由是__________________。
(3)a的取值范围是__________________。
解析:本题是对强酸、强碱中和规律的研究,综合性较强。强酸与强碱完全中和,pH之和必为14,即a+b=14,由此可知a=3或a=5均不合题意。难点在a的取值范围的确定上。
 =
= =10a+b-14<1
=10a+b-14<1
所以a+b-14<0,而a=0.5b,即3a<14,a<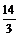 。
。
又pH=b=2a>7,a>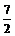 ,所以
,所以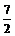 <a<
<a<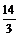 。
。
答案:(1)否 若a=3,则b=6,溶液显酸性,与题意不符,故a≠3
(2)否 若a=5,ca(H+)=10-5 mol·L-1,则b=10,cb(OH-)=10-4 mol·L-1,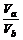 =
=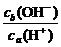 >1,不符合题意,故a≠5
>1,不符合题意,故a≠5
(3)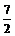 <a<
<a<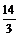
[例3]在pH都等于9的NaOH溶液和CH3COONa溶液中,设由水电离产生的OH-离子浓度分别为Amol/L和Bmol/Lmol则A和B的关系是
A. B.
C. D.
解析:本题是在纯水中加入碱和盐溶液后判断水的电离情况。的NaOH溶液中,,而NaOH只提供OH-,不提供H+,所以溶液中的H+就是水提供的,。
pH=9的CH3COONa溶液中,,由知,
,CH3COONa不提供H+和OH-,两者全部来自于水的电离。,所以答案为B。应指出的是,这里的,因水电离出来的有相当一部分转化为CH3COOH了,=
。 本题也可以根据“酸碱抑制,盐促进”来估算,立即得答案为B。
答案:B
[例4] 常温下的两种一元酸溶液A和B,分别加水1000倍稀释,其pH与所加水的体积变化如下图所示,则下列结论中正确的是
A. A酸比B酸的电离程度小 B. B酸比A酸容易电离
C. B是弱酸,A是强酸 D. pH=1时,B酸的物质的量浓度比A酸大
 解析:如果一元酸是强酸,pH=1时,,加水稀释103倍后,此时,
解析:如果一元酸是强酸,pH=1时,,加水稀释103倍后,此时,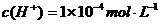 ,。如果是一元弱酸,则。从图上可以看出A酸为强酸而B酸是弱酸。pH=1时,B酸的物质的量浓度比A酸大。所以C和D是正确的。
,。如果是一元弱酸,则。从图上可以看出A酸为强酸而B酸是弱酸。pH=1时,B酸的物质的量浓度比A酸大。所以C和D是正确的。
答案:CD
2.溶液酸碱性的基本规律
(1)溶液酸碱性判定规律
①pH相同的酸,酸越弱,酸物质的量浓度越大;pH相同的碱,碱越弱,碱物质的量浓度越大。
②酸与碱的pH之和为14,且等体积混合时,强酸与强碱混合,pH=7;强酸与弱碱混合,pH>7;强碱与弱酸混合,pH<7。
(2)稀释后溶液pH的变化规律
①对于强酸溶液,每稀释10n倍,pH增大n个单位(增大后不超过7)。
②对于强碱溶液,每稀释10n倍,pH减小n个单位(减小后不小于7)。
③对于pH相同的强酸与弱酸(或强碱与弱碱)稀释相同倍数时,pH变化不同,其结果是强酸或强碱的变化的程度大。
④对于物质的量浓度相同的强酸和弱酸,稀释相同倍数,pH变化不同,其结果是强酸稀释后pH增大得比弱酸快(强碱、弱碱类似)。
1.水的电离和影响因素
⑴水是一个极弱的电解质,存在电离平衡:
H2O H++OH-
H++OH-
(2)影响水电离平衡的因素
①酸、碱
在纯水中加入酸或碱,均使水的电离平衡左移,此时若温度不变,KW不变,c(H+)发生改变,pH也随之改变;若向水中加入酸,则c(H+)增大,c(OH-)变小,pH变小。
②温度
若升温,由于水电离吸热,升温将促进水的电离,故平衡右移,c(H+)、c(OH-)同时增大,pH变小,但由于c(H+)与c(OH-)始终保持相等,故仍显中性。
③易水解的盐
在纯水中加入能水解的盐,不管水解后溶液显什么性,均促进水的电离,使水的电离程度增大,但只要温度不变,KW不变。
④其他因素
如向水中加入活泼金属,由于与水电离出的H+直接作用,因而促进了水的电离平衡向电离的方向移动。
3.酸、碱批示剂及溶液pH值的实验测定方法
⑴常用指示剂及变色范围
|
指示剂 |
变色范围 |
|
甲基橙 |
|
|
酚酞 |
|
|
石蕊 |
|
⑵测定溶液pH值方法:
精确方法:pH计法
常用方法:pH试纸法 。不能先用水湿润pH试纸的原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com