
3.教学中适时设疑、层层设疑,有利于重点难点知识的突破与跨越,同时培养学生独立思考的习惯。
●参考练习
2.通过对比有机化学反应中的氧化反应和还原反应,能使学生从本质上认识它们的区别。
1.充分利用化学实验这一重要媒体,引导学生观察、分析、推理、抽象概括,从而认识乙醛的重要化学性质--加成反应和氧化反应。
3.化学性质
(1)加成反应
(2)氧化反应
a.催化氧化
|
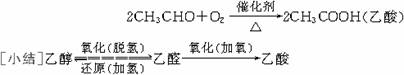
 2CH3COOH(乙酸)
2CH3COOH(乙酸)
b.燃烧
2CH3CHO+5O2 4CO2+4H2O
4CO2+4H2O
c.被弱氧化剂氧化
Ⅰ.银镜反应
Ⅱ.和Cu(OH)2反应
d.使酸性KMnO4溶液和溴水褪色
●教学说明
围绕教学重点、难点,主要采用了启发、对比、设疑、实验相结合的方法。
2.物理性质
1.分子结构
1.分子结构
[师]展示乙醛分子的比例模型,并让学生根据乙醇催化氧化反应的本质,写出乙醛的分子式、结构式、结构简式及官能团。
[一个学生在黑板上写,其他学生写在练习本上]
[学生板演,教师巡视]
分子式:C2H4O
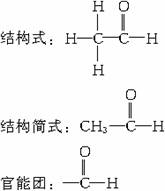
[师]乙醛的结构简式还可以写成CH3CHO,醛基也可以写成-CHO,但不能写成-COH。
[师]写出-CHO的电子式。
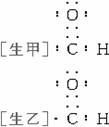
[师]醛基是一个中性基团,本身未失e-,也未得到e-,因此乙的写法正确。甲误以为“-”应表示一对共用电子对。
[师]展示乙醛样品,让学生闻其气味,并观察其颜色、状态,结合教材164页相关内容叙述乙醛的重要物理性质。
[板书]2.物理性质
[生]乙醛是无色、具有刺激性气味的液体,密度比水小,沸点是20.8℃,易挥发,易燃烧,能跟水、乙醇、氯仿等互溶。
[师]官能团决定物质的化学性质,乙醛的化学性质是由醛基决定的。请同学们分析醛基的结构,推测其在化学反应中的断裂方式。
[生]C==O键和C-H键都有极性,都可能断裂。
[师]下面我们通过乙醛的化学性质来验证同学们的推断是否正确。
[板书]3.化学性质
[师]C==O键和C==C键断键时有类似的地方,说明乙醛可以发生什么类型的反应?
[生]加成反应。
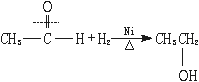
[师]请同学们根据加成反应的概念写出CH3CHO和H2加成反应的方程式。
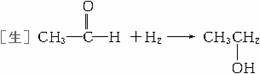
[师]指出:此反应在Ni作催化剂、加热的条件下才能进行。
[板书](1)加成反应
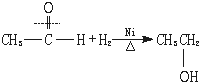
[师]说明:①醛基与H2的加成是在分子中引入-OH的一种方法。②工业上并不用此法合成乙醇。
[设疑]乙醇在一定条件下被催化氧化为乙醛,实质是脱去两个氢原子,我们称之为氧化反应。而乙醛与H2的加成是乙醇催化氧化的相反过程,与氧化反应相对应,此反应还应属于什么反应类型?
[生]还原反应。
[师]在有机化学反应中,通常把有机物分子中加入氢原子或失去氧原子的反应,叫做还原反应;如乙醛和H2的加成。把有机物分子中加入氧原子或失去氢原子的反应,叫做氧化反应。如乙醇的催化氧化。
[师]说明:有机化学反应中的氧化反应、还原反应是针对有机物划分的。实际上都是氧化还原反应,氧化反应和还原反应总是同时进行,相互依存的,不能独立存在。只不过有机化学反应中的氧化反应是有机物被氧化,无机物被还原;还原反应中是有机物被还原,无机物被氧化罢了。
[设疑]乙醛可以被还原为乙醇,能否被氧化呢?请同学们根据乙醛分子式中碳的平均化合价进行分析、讨论。
[生]由CH3CHO变为CH3CH2OH,碳的平均化合价从-1价降到-2价,CH3CHO被还原。由于CH3CHO中碳的平均化合价为-1价,而碳的最高价态为+4价,因此乙醛还可以被氧化,发生氧化反应。
[板书](2)氧化反应
[师]在一定温度和催化剂存在的条件下,乙醛能被空气中的氧气氧化成乙酸。工业上可以利用此反应制取乙酸。
[板书]a.催化氧化
[师]根据乙醛的物理性质,说明它还可以燃烧。请同学们写出乙醛完全燃烧的方程式。
[板书]b.燃烧
2CH3CHO+5O2 4CO2+4H2O
4CO2+4H2O
[过渡]乙醛不仅能被氧气氧化,还能被某些氧化剂氧化。
[板书]c.被弱氧化剂氧化
[演示实验6-7]
第一步:在洁净的试管里加入1 mL 2%的硝酸银溶液,边摇动试管,边逐滴滴入2%的稀氨水。
[问]大家看到了什么现象?写出化学方程式。
[生]生成白色沉淀。
AgNO3+NH3·H2O====AgOH↓+NH4NO3
第二步:继续滴加稀氨水,至最初产生的沉淀刚好溶解为止。
[讲述]大家看到沉淀溶解了,这是因为AgOH和氨水反应生成了一种叫氢氧化二氨合银的络合物,该溶液称为银氨溶液,它是一种弱氧化剂。
[副板书]AgOH+2NH3·H2O====(Ag(NH3)2)OH+2H2O
[师]下面我们看一看这种弱氧化剂能否与乙醛发生反应。
[演示]第三步:在银氨溶液中滴入3滴乙醛,振荡后放在热水中温热。
现象:试管内壁附上了一层光亮如镜的银。
[师]从现象可以看出,反应中化合态银被还原,乙醛被氧化。乙醛被氧化成乙酸,乙酸又和氨反应生成乙酸铵。这个反应叫银镜反应。
[板书]Ⅰ.银镜反应
CH3CHO+2(Ag(NH3)2)OH CH3COONH4+3NH3+2Ag↓+H2O
CH3COONH4+3NH3+2Ag↓+H2O
[师]从反应断键情况来看,还是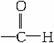 中C-H键断裂,相当于在C-H键之间插入1个氧原子。从化合价升降守恒来看,有1 mol
中C-H键断裂,相当于在C-H键之间插入1个氧原子。从化合价升降守恒来看,有1 mol 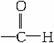 被氧化,就应有2 mol银被还原。因此银镜反应不仅可用于检验醛基的存在,也常用于测定有机物中醛基的数目。
被氧化,就应有2 mol银被还原。因此银镜反应不仅可用于检验醛基的存在,也常用于测定有机物中醛基的数目。
乙醛不仅可被弱氧化剂银氨溶液氧化,还可以被另一种弱氧化剂氧化。
[板书]Ⅱ.和Cu(OH)2反应
[演示]P165实验6-8。
现象:试管内有红色沉淀产生。
[师]这种红色沉淀是Cu2O。请同学们写出该反应涉及到的化学方程式。
[学生板演]CuSO4+2NaOH====Cu(OH)2↓+Na2SO4
2Cu(OH)2+CH3CHO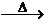 Cu2O↓+CH3COOH+H2O
Cu2O↓+CH3COOH+H2O
[师]由于Cu(OH)2是微溶物,刚制备的Cu(OH)2为悬浊液,放置稍长时间就可生成沉淀。因此实验中所用Cu(OH)2必须是新制的,且NaOH要加得过量一些,因为本实验需在碱性条件下进行。
[讨论]乙醛能否使溴水和酸性KMnO4褪色?
[生]能。因为溴和酸性KMnO4都是强氧化剂,可以把乙醛氧化。
[师]乙醛的这些重要性质,都有重要用途,下面我们列表总结如下:
[投影小结]
乙醛的氧化反应
|
氧化剂 |
反应条件 |
现象 |
化学反应实质 |
重要应用 |
|
O2 |
点燃 |
燃烧有黄色火焰 |
2CH3CHO+5O2 4CO2+4H2O 4CO2+4H2O |
-- |
|
O2 |
催化剂,加热 |
-- |
-CHO变-COOH 2CH3CHO+O2  2CH3COOH 2CH3COOH |
工业制取乙酸 |
|
银氨 溶液 |
水浴加热 |
形成银镜 |
-CHO变-COOH CH3CHO+2Ag(NH3)2OH  CH3COONH4+2Ag↓+3NH3+H2O |
工业制镜或保温瓶胆,实验室检验醛基 |
|
Cu(OH)2 |
加热至沸腾 |
产生红色沉淀 |
-CHO变-COOH CH3CHO+2Cu(OH)2  CH3COOH CH3COOH+Cu2O ↓+2H2O |
实验室检验醛基、医学上检验尿糖 |
[小结]通过对乙醛化学性质的学习,证明了同学们的推测完全正确,-CHO中的C==O键和C-H 键都能断裂。在乙醛和氢气的加成反应中,是C==O键断裂,在乙醛被氧化的反应中是C-H 键断裂。通过乙醛性质的学习,我们也知道了有机反应中加氧或去氢称为氧化反应,加氢或去氧称为还原反应,虽然和无机化学中对氧化还原反应的定义不同,但本质是一样的。课下请同学们根据有机反应中氧化反应和还原反应的定义,总结你学过的化学反应哪些属于氧化反应,哪些属于还原反应。
[作业]P166一、1、3 二、3 四
●板书设计
第五节 乙醛 醛类(一)
(一)本课预习题:
1、用电器的电功率等于额定电功率时,加在用电器两端电压______用电器的额定电压
(填“等于”、“不等于”),通过用电器的电流________用电器的额定电流。
2、一个“220V,100W”的灯泡,接在110V的电源上,该灯泡额定功率为______W,
实际功率为_______W。
3、用一个额定电压为220V的电热煮水器煮沸一壶水需要时间t,如果不考虑煮水器的
热量损失和电热丝电阻受温度的影响,那么:
A、当线路电压为110V时,煮沸一壶水需2t ;
B、当线路电压为110V时,煮沸一壶水需4t ;
C、当线路电压为55V时,煮沸一壶水需4t ;
D、当线路电压为55V时,煮沸一壶水需16t 。
4、把“220V,100W”的A灯和“220V,200W”的B灯串联起来,接到220V的电路
中,导线的电阻不计,则两灯:
A、电阻之比为R :R
:R = 2:1 ; B、电压之比为U
= 2:1 ; B、电压之比为U :U
:U =1:2 ;
=1:2 ;
C、功率之比为P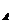 :P
:P = 2:1 ; D、相同的时间内电热之比为Q
= 2:1 ; D、相同的时间内电热之比为Q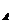 :Q
:Q = 2:1 。
= 2:1 。
5、下列说法中正确的是:
A、一个电阻和一根无电阻的理想导线并联,总电阻为零;
B、并联电阻任一支路的电阻都大于电阻的总电阻;
C、并联电路任一支路的电阻增大(其它支路不变),则总电阻也增大;
D、并联电路任一支路电阻增大(其它支路不变),则总电阻一定减小。
(四)并联电路
1、并联电路:把几个导体并列地连接起来组成的电路。
2、并联电路的基本特点:
(1)电路中各支路两端的电压相等,即U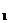 = U
= U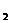 = U
= U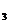 =……..;
=……..;
(2)电路中的总电流等于各支路的电流之和,即I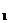 +I
+I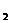 +……;
+……;
3、并联电路的重要性质:
(1)总电阻: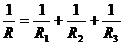 +…….;
+…….;
推论:各支路的电阻均相同为r时,R=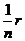 ;只有两个电阻并联时,
;只有两个电阻并联时,
R=R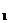 R
R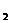 /(R
/(R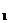 + R
+ R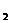 );并联总电阻小于任一支路的电阻;任一支路电阻增大,总
);并联总电阻小于任一支路的电阻;任一支路电阻增大,总
电阻增大;反之减小。
(2)电流分配:I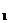 R
R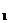 =I
=I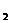 R
R =………;
=………;
注意:并联电阻具有分流作用,电阻越小,分得的电流越大。
(3)功率分配:P R
R =P
=P R
R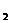 = ……..;
= ……..;
注意:P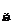 = P
= P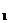 + P
+ P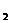 +…….;
+…….;
(4)并联电路的分析方法:
应注意分清干路和支路,再灵活应用并联电路的特点和性质分析讨论。
(三)串联电路:
1、串联电路:把导体一个一个依次连接组成的电路。
2、串联电路的基本特点:
(1)电路中各处的电流处处相等;
(2)电路两端的总电压等于各部分电路两端电压之和;
3、串联电路的重要性质:
(1)总电阻:R=R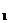 +R
+R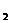 +R
+R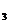 +…….;
+…….;
注意:总电阻大于任一导体的电阻。
(2)电压分配:U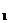 / R
/ R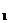 =U
=U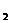 / R
/ R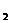 =…….;
=…….;
注意:串联电阻具有分压作用,电阻越大,分得的电压越大。
(3)功率分配:
P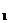 / R
/ R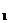 = P
= P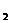 / R
/ R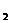 = ………;
= ………;
注意:P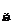 = P
= P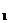 + P
+ P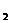 +…….;
+…….;
4、串联电路的分析方法:
在熟记串联电路的特点和性质的基础上,灵活运用。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com