
5、下列四幅图片反映的重大事件对人类历史发展均具有重大意义。其共同的作用是

A.促进世界资本主义发展 B.发挥了马克思主义哲学指导作用
C.促进了人们的思想解放 D.推动近代自然科学的产生和发展
4、悉尼·胡克《历史中的英雄》:“假如我们给英雄下这样一个定义:英雄就是具有事变创造性并且能够重新决定历史进程的某些人,那么,紧跟着下一步的推论应该是:一个民主的社会对于英雄人物必须永远加以提防……因为天才和能力时常会被滥用。”古代希腊提防英雄人物的关键措施是
A.设立公民大会 B.成立五百人议事会 C.实行陶片放逐法 D.轮流执政、抽签选举
3、张鸣在《苏维埃乡村追求》中指出:“在南京国民政府统治的前十年……苏维埃运动在中国农村的开展以及农民对这个运动的理解,暗示了中国革命的列宁主义趋向以及这种趋向的中国化命运”。其中“这种趋向的中国化命运”主要体现在
A.苏维埃政权的建立 B.工农武装割据的形成
C.红军长征的胜利 D.国共两党合作的实现
2、著名历史学家陈旭麓先生在《中国近代社会的新陈代谢》一书中所说:“从爱国主义出发回到中世纪(中世纪原指欧洲黑暗的中世纪时期,这里的“中世纪”指的是封建专制国家)。”此评价最适合于
A.太平天国运动 B.新文化运动 C.义和团运动 D.辛亥革命
1、著名学者黄仁宇在论及某王朝的统治政策时写道:“新朝代遇到的第一个大问题是帝国跨地过广,不能全部由中央集权管制,于是采取了一种‘斑马式’的省级组织。”这里“‘斑马式’的省级组织”最有可能是指
A.郡县制 B.郡国并行制 C.分封制 D.行省制度
18. (10分)工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1: ▲ 。
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为 ▲ 。
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+--Mn2++Fe3++H2O(未配平)
①V的取值范围为 ▲ ;
②若V=35,试计算混合物中CuS的质量分数。
▲
选做题(本题包括1小题,共12分)
下列A、B两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
19(A)(12分) 工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)基态钛原子的核外电子排布式为 ▲ 。
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于 ▲ 晶体。
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是 ▲ 。
A. SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42- 稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ▲ ,原因是 ▲ 。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ▲ ,分子的空间构型为 ▲ 。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为 ▲ 。

17.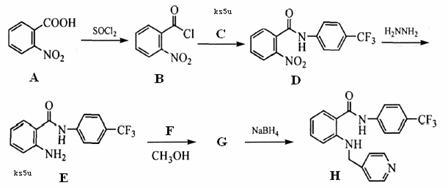 (14分)新一代药物H具有良好的抗肿瘤活性,其合成路线如下:
(14分)新一代药物H具有良好的抗肿瘤活性,其合成路线如下:
已知: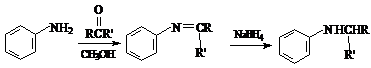
反应物中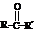 ,R、R’可为:H、CH3、NH2等。
,R、R’可为:H、CH3、NH2等。
(1)A→B的反应类型是 ▲ 。
(2)写出C的结构简式 ▲ 。
(3)物质D发生水解反应的方程式为 ▲ 。
(4)写出E→G的反应方程式 ▲ 。
(5)写出符合下列条件的物质A的同分异构体的结构简式 ▲ 。
①属于硝酸酯 ②苯环上的一氯代物有两种
(6)苯并咪唑类化合物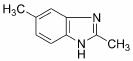 是一种抗癌、消炎药物。利用题给相关信息,以
是一种抗癌、消炎药物。利用题给相关信息,以 、CH3COCl、CH3OH为原料,合成过程中无机试剂任选;合成路线流程图示例如下:
、CH3COCl、CH3OH为原料,合成过程中无机试剂任选;合成路线流程图示例如下:
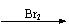 CH3CH2OH
CH3CH2OH
 H2C=CH2
BrH2C-CH2Br
H2C=CH2
BrH2C-CH2Br
▲
16.(10分)氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,容易引起爆炸。
(1)三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为 ▲ 。
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为 ▲ 。该工艺选择氯气的优点是 ▲ 。(答一点即可)
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为10-3 mol/L,则理论上生成的SO42-为 ▲ mol/L。
(4)生产和实验中广泛采用甲醛法测定样品的含氮量。甲醛和铵根离子的反应如下:
4NH4+ + 6HCHO =(CH2)6N4H+(一元酸)+ 3H+ + 6H2O
实验步骤如下:
①甲醛中常含有微量甲酸,应先除去。可取甲醛b mL于锥形瓶,加入1滴酚酞,用浓度为C mol/L的NaOH溶液中和,滴定管的初始读数V1 mL,当溶液呈微红色时,滴定管的读数V2 mL。
②向其中加入饱和食盐水试样a mL,静置1分钟。
③再加1~2滴酚酞,再用上述NaOH溶液滴定至微红色,滴定管的读数V3 mL。
则饱和食盐水中的含氮量为 ▲ mg/L。
15.(10分)电镀废水一种特殊处理工艺如下:
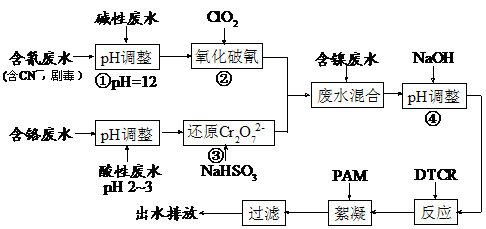
图中DTCR能与Ni2+、Zn2+、Cu2+、Cr3+等各种重金属离子迅速反应,生成不溶水的螯合盐,再加入少量絮凝剂下,形成絮状沉淀,从而达到捕集去除重金属的目的。
试回答下列问题:
(1)步骤②ClO2可将CN-直接氧化成两种无毒气体,该反应的离子方程式为 ▲ 。
(2)若含氰废水流量为0.8 m3/h,含氰(CN-)浓度为300 mg/L,为确保安全,实际投放ClO2为理论值的1.3倍,则完成氧化每小时共需投入ClO2质量为 ▲ kg。
(3)步骤③中氧化剂与还原剂的物质的量之比为 ▲ 。
(4)PAM为丙烯酰胺(CH2=CHCONH2)的聚合物,该聚合物的结构简式为 ▲ 。
(5)本工艺中将废水分类收集,分而治之的优点是 ▲ 。
14. (10分)实验室用共沉淀法制备纳米级Fe3O4的流程如下:

该方法的关键为促进晶粒形成,并控制晶体生长。试回答下列问题:
(1)该反应原理的离子方程式可表示为 ▲ 。
(2)反应温度需控制在50℃,其方法是 ▲ ,温度偏低造成产量低的可能是 ▲ 。
(3)在搅拌Ⅱ的过程中还需加入10 mL正丙醇,其作用是 ▲ 。
(4)黑色糊状物转移至烧杯中,用倾析法洗涤,检验洗净的操作是 ▲ 。
(5)由上述分析可知,影响纳米级Fe3O4粒径大小的因素有(写出一条) ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com