
22.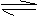 (12分)恒温下,将a
mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2(g)+3H2(g) 2NH3(g)
(12分)恒温下,将a
mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2(g)+3H2(g) 2NH3(g)
(1)若反应进行到某时刻t时,n(N2)=13mol,n(NH3)=6mol,则a= ▲ 。
(2)反应达到平衡时,混合气体的体积为 716.8L(标况下),其中NH3的含量(体积分数)为25%。则平衡时NH3的物质的量是 ▲ mol。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)
为n(始):n(平)= ▲ .
(4)原混合气体中,a:b= ▲ 。
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)= ▲ 。
(6)平衡混合气体中,n(N2):n(H2):n(NH3)= ▲ 。
 衢州一中2010学年度第一学期高三第一次检测试卷
衢州一中2010学年度第一学期高三第一次检测试卷
21.(12分)以苯为主要原料,可以通过下图所示途径制取阿司匹林和冬青油:
请按要求回答:(1)请写出有机物的A分子式_____▲ ____;C的结构简式: ____▲ ___。
(2)写出变化过程中①、⑥的化学方程式(注明反应条件)反应①__▲___;反应⑥_▲_。
(3)变化过程中的⑦属于_____▲ ______反应。
(4)物质的量相等的冬青油和阿司匹林完全燃烧时消耗氧气的量,冬青油比阿司匹林__▲ ____。
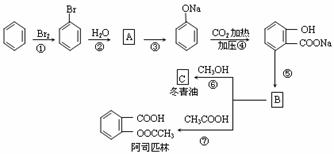
20.(12分)图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化 关系,其中有些反应物或生成物已经略去。试回答下列问题:
(1) 工业上,在电解A溶液的设备中将阴极区和阳极区用 ▲ 隔开。
(2) Z→L反应的名称是 ▲ ,K的电子式为 ▲ 。
(3) 写出B→F的离子方程式 ▲ 。(4) 写出K与CO2反应的化学方程式 ▲ 。
(5) Y与NaClO和B混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出有关反应的离子方程式 ▲ 。
19、(10分)某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应生成只有CuCO3一种沉淀;乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①过滤②洗涤③干燥。
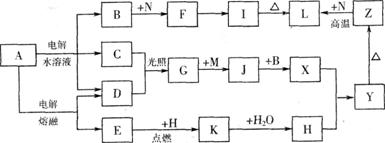
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
⑴各装置连接顺序为 → → 。⑵装置C中装有试剂的名称是 ▲ 。
⑶能证明生成物中有CuCO3的实验现象是 ▲ 。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。

⑴ 实验开始时要通入过量的空气其作用是 ▲ 。
⑵若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为: ▲ 。
18、用二根铂丝作电极插入KOH溶液中,分别向两极通人甲烷和氧气,可作为一种燃料电池的模拟装置。试判断下列说法正确的是
A.通氧气的铂极为负极 B.此电池反应为CH4+2O2=CO2+2H2O
C.此电池放电时,KOH浓度减小 D.此电池放电时,KOH浓度不变
第Ⅱ卷 非选择题(共46分)
17、已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
根据上述电离常数分析,下列表述不正确的是
A.25℃时,等物质的量浓度的各溶液pH关系为:
pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中
c(Na+)=c(CN-),则a一定大于b
C.2 NaCN + H2O + CO2 =2 H CN + Na2 CO 3
D.2C H3C O O H + Na2CO3 → 2 C H 3C O O Na + H2O + CO2 ↑
16.下列离子反应,表达正确的是
A.向硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7:
2H+ + SO42-+ Ba2+ + 2OH-= BaSO4↓ + 2H2O
B.CaCO3与醋酸(CH3COOH)反应:CaCO3 + 2H+=Ca2+ + CO2↑+ H2O
C.向含有Fe2O3悬浊液中通入HI: Fe2O3 + 6H+=2Fe3+ + 3H2O
D.MgSO4溶液跟Ba(OH)2溶液反应:SO42― + Ba2+=BaSO4↓
15、除去SO2气体中少量的SO3,可通过装有下列试剂的洗气瓶,其中正确的是
①NaOH溶液 ②98.3%H2SO4 ③饱和NaHSO3溶液 ④ Na2SO3溶液
A. ① ② B. ② ③ C. ④ D. ① ④
14、有Fe2+ ﹑NO3- ﹑Fe3+、NH4+ ﹑H2O 和H+六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是
A.氧化剂与还原剂的物质的量之比为8∶1
B.还原产物为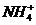
C.若有1 参加还原反应,则转移8
参加还原反应,则转移8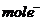
D.若把该反应设计为原电池,则负极反应为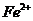 -
-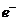 =
=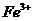
13、在t ℃下,某反应达到平衡,平衡常数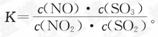 恒容时,温度升高,NO浓度减小。下列说法正确的是:
恒容时,温度升高,NO浓度减小。下列说法正确的是:
A.该反应的焓变为正值 B.恒温下减小压强,反应体系的颜色加深
C.升高温度,逆反应速率减小 D.该反应化学方程式为NO2+SO2  NO+SO3
NO+SO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com