
21、(12分)某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
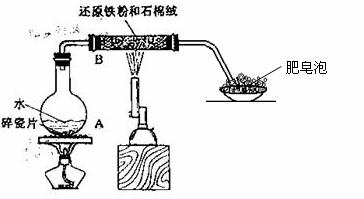
请回答下列问题:
(1)硬质试管中 发生反应的化学方程式为____________________________ 。
发生反应的化学方程式为____________________________ 。
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许 其中的固体物质溶于稀硫酸得溶液B;
其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中所含固体物质的成分有: 种(填1种、2种、1种或2种),具体情况是 ,若溶液未变红色则说明硬质试管中固体物质的成分有: 种(填1种、2种、1种或2种),具体情况是 。
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是: (用离子方程式表示)。
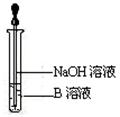 (4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按右图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式:
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按右图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式:
。
20.(12分) A、B、C、D、E、X、Y为中学常见的七种物质,它们有如下转化关系(部分产物与反应条件略去):
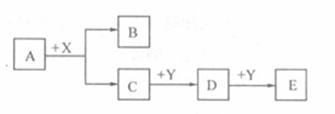
(1)若A为金属单质,B为氢气,X为盐酸,Y为强碱溶。则A物质的名称是 ;D与Y反应的离子方程式为 ;
(2)若A、C为同主族元素组成的单质,通常状况下,A为气体,C为液体,Y为金属单质。则A→C的反应类型是 ;将X通入A的溶液中,可观察到的现象是 ;C→D的化学反应方程式为 。
(3)若A、C为为短周期不同主族元素组成的单质,通常状况下,A、C均为固体,X、Y为气体。则A→C的反应方程式是 ;该反应发生时盛有X的装置 (填是、否)需要做什么处理中,如需要怎么处理 (如不需要此问不需作答)。为什么: 。
19、(14分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
⑴ L的元素符号为________ ; M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,原子结构示意图为: 其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 m ol·L- 1 c.-20.6 mol·L-1 d.-241.8
kJ·mol-1
⑷用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:____________________;
ol·L- 1 c.-20.6 mol·L-1 d.-241.8
kJ·mol-1
⑷用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:____________________;
由R生成Q的化学方程式:__________________________;
18、(10分)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-。将该混合物溶于水后得澄清溶液.现取3份l00mL该溶液分别进行如下实验:
|
试验序号 |
试验内容 |
试验结果 |
|
1 |
加AgNO3溶液 |
有白色沉淀生成 |
|
2 |
加足量NaOH溶液并加热 |
收集到气体 1.12L(已折算成标准状况下的体积) |
|
3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中 加足量稀盐酸,然后干燥、称量 加足量稀盐酸,然后干燥、称量 |
第一次称量读数为 6.27g,第二次称量读数为
2.33g |
试回答下列问题: (1)根据实验1对Cl-是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”);根据实验l-3判断混合物中一定不存在的离子是 。 (2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):

|
阴离子符号 |
物质的量浓度(mo1·L-) |
|
|
|
|
|
|
(3)试确定K+是否存在? ,判断的理由是 .
17、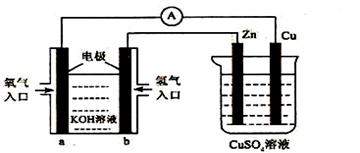 已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理的一项是
A.该装置中Cu极为正极
B.当铜极的质量变化为12 .8g时,a极上消耗的O2在标准状况下的体积为2.24L
C.b极反应的电极反应式为:H2-2e-=2H+
D.一段时间后锌片质量减少
已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理的一项是
A.该装置中Cu极为正极
B.当铜极的质量变化为12 .8g时,a极上消耗的O2在标准状况下的体积为2.24L
C.b极反应的电极反应式为:H2-2e-=2H+
D.一段时间后锌片质量减少
第Ⅱ卷非选择题 (49分)
16、V L Fe2(SO4)3溶液中含Fe3+m g,溶液中SO2-4的物质的量浓度是
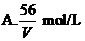
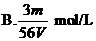
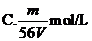
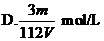
14、下列关于阿伏加德罗常数NA的说法正确的是 ( )
A.铜与热的浓H2SO4反应放出l mol气体时转移的电子数为2NA
 B.1mol冰中含有的氢键数目为NA
B.1mol冰中含有的氢键数目为NA
C.标准状况下,22.4 L CCl4含有的分子数为NA
D.1 mol羟基含有的电子数为7NA
15如右图所示,两个连通容器用活塞分开,左右两室各充入一定量NO和O2,且恰好使两容器内气体密度相同,打开活塞,使NO与O2充分反应,最终容器内混合气体密度比原来( )
A.增大 B.减小 C.不变 D. 无法确定
13、一定体积0.01mol/L的稀硝酸溶液恰好能氧化一定质量的铁、铝混合物,已知两种金属均被氧化为最高价态,还原产物只有NO。若用0.01mol/L的NaOH溶液溶解相同质量的该混合物,当反应完全时所需氢氧化钠溶液的体积是稀硝酸溶液的1/5,则样品中铁、铝的物质的量之比为 A.2:3 B.1:3 C.1:4 D.5:3
12、己知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ/mol;HCl(aq)与NaOH(aq)反应的△H= -55.6kJ/mol。则HCN在 水溶液中电离的△H等于
A.-67.7 kJ/m
水溶液中电离的△H等于
A.-67.7 kJ/m ol B.-43.5 kJ/mol C.+43.5 kJ/mol D.+67.7kJ/mol
ol B.-43.5 kJ/mol C.+43.5 kJ/mol D.+67.7kJ/mol
11、把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为 A.0.1(b-2a)mol/L B.10( 2a-b)mol/L C.10(b-a)mol/L D.10(b-2a)mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com