
硝酸具有三性:不稳定性、强氧化性和酸性。硝酸浓度越高,氧化性越强,还原产物的价态越高;浓度越稀,氧化性越弱,还原产物的价态越低。
[练习]1、锌与某浓度的硝酸发生氧化-还原反应,其物质的量之比为2:5,则硝酸的还原产物是( )
(A)N2 (B)N2O (C)NH4NO3 (D)NO2
2、下列含氮的化合物中属于酸酐的是( )
(A)NO (B)NO2 (C)N2O3 (D)N2O5
氨水中存在哪些分子和离子: ,计算氨水质量分数时,溶质是 ,而不是 ,氨水的浓度越大,密度越 。
[练习]一定温度下,将质量分数为10%和20%的氨水等体积混合,所得溶液的质量分数为( )
(A)>15% (B)<15% (C)=15% (D)无法确定
(1)氨气分子是 型的 分子,由于分子中有 ,所以可以和H+形成 。NH4+的构型为 。写出氨气和H+反应的电子式形成过程: 。
(2)实验室制氨气的反应原理是(用化学反程式表示):
但由于是固体反应,所以不能用 表示,只能写化学反程式。
实验中由于氨气极易溶于水,所以吸收装置应用
氨气不能用 性干燥剂干燥,也不能用 干燥,一般用 干燥。
(3)NH4+的检验:向氨盐溶液中加入强碱并加热,放出氨气,能使润湿的红色石蕊试纸变红,说明有NH4+存在。
[注意]①石蕊试纸必须润湿②必须加强碱③必须加热
[练习]
1、把aL含(NH4)2SO4和NH4NO3 的混合液分为两等份:一份加入bmol 烧碱并加热,恰好把NH3全部赶出,另一份需含cmolBaCl2 的溶液,使沉淀反应刚好完全,则NO3- 的浓度是( )
(A)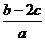 mol/L(B)
mol/L(B) mol/L(C)
mol/L(C)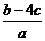 mol/L(D)
mol/L(D) mol/L
mol/L
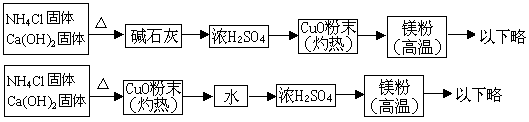
 2、氨跟氧化铜反应可以制备氮气(2NH3+3CuO==== 3Cu+3H2O+N2),而氮气和镁在高温下反应得到氮化镁,但氮化镁遇水即反应得到Mg(OH)2和NH3。下面是甲、乙两同学提出的制备氮化镁的两种实验方案示意图(实验前系统内空气已排除;图中箭头表示气体的流向)。
2、氨跟氧化铜反应可以制备氮气(2NH3+3CuO==== 3Cu+3H2O+N2),而氮气和镁在高温下反应得到氮化镁,但氮化镁遇水即反应得到Mg(OH)2和NH3。下面是甲、乙两同学提出的制备氮化镁的两种实验方案示意图(实验前系统内空气已排除;图中箭头表示气体的流向)。
填空回答下列问题:
(1)甲、乙两生提出的实验方案是否能制得氮化镁?甲 ;乙 。
(2)具体说明不能制得氮化镁的原因(如两个方案都能制得氮化镁,此小题不用回答)
[练习] 1、在新疆与青海两省交界处有一狭长山谷,当地牧民经常遇到在风和日丽的晴天顷刻间电闪雷鸣,狂风大作,人畜皆遭雷击而倒毙。奇怪的是这里牧草茂盛,四季长青。被当地牧民称为“魔鬼谷”。请用化学方程式表示“魔鬼谷” 牧草茂盛,四季长青的原因:
2、生物固氮是指( )
(A)生物从土壤中吸收含氮养料
(B)豆科植物根瘤菌将含氮化合物转变为植物蛋白质
(C)将氨转变成硝酸及其它氮的化合物
(D)生物将空气中的氮气转变成含氮化合物
27、 (10分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率
(10分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率
不同,同时测定实验室条件下的气体摩尔体积。
设计的简易实验装置如右图。
该实验的主要操作步骤如下:
①配制浓度均为1 mol·L-1盐酸和醋酸溶液;
②用 量取10.00 mL 1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为 ;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录 ;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应 ,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:
____________________。
⑵本实验中应选用 (填序号)的量筒。A.100 mL B.200 mL C.500 mL
⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为Vm= 。
2010-2011学年度第一学期立人高级中学
高三化学九月月考试题
26、(8分)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO 和HNO3 ,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为_______________。
(2)配平该反应的化学方程式,并用单桥法标出电子转移的方向和数目:
______________________________________________________________________。
若反应中生成0.2 mol HNO3,转移的电子数目为______________________个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是 。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外。还肯定有______ ______(填化学式)。
25、(12分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
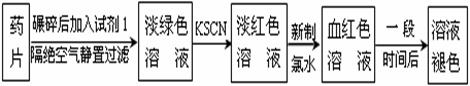
(1) 试剂1是 ,加入新制氯水后溶液中发生的离子反应方程式是:
, ;
(2) 加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了淡红色,其可能的原因是 ;
(3) 在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
|
编号 |
猜
想 |
|
甲 |
溶液中的+3价Fe又被还原为+2价Fe |
|
乙 |
溶液中的SCN-被过量的氯水氧化 |
|
丙 |
新制的氯水具有漂白性,将该溶液漂白 |
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充)
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
|
|
|
|
|
|
|
24、(10分)有原子序数依次增大的六种短周期主族元素A、B、C、D、E、F。其中A与D、B
与E分别同主族,B原子最外层电子数为内层电子数的2倍;F元素的原子半径在所在周期
的主族元素中最小;C与A、D都可形成两种化合物,且所形成的化合物中各有一种具有漂白性。B、E分别与C形成的化合物晶体类型不同。试回答下列问题。
(1)C、D以原子个数比为1∶1形成的化合物的电子式为 。
(2)用电子式表示C、D以原子个数为1:2形成的化合物的形成过程
(3)试写出工业用电解溶液法得到单质F的离子方程式
。
(4)写出以上六种元素形成的含18个电子的分子式 (任写三种)。
(5)已知几种元素之间形成的化学键的键能如下:
|
化学键 |
A-A |
A-F |
B-E |
C-E |
E-E |
E-F |
|
键能(kJ/mol) |
436 |
431 |
347 |
460 |
176 |
360 |
工业上用含有E、F两种元素(原子个数比为1∶4)的化合物(高温为气态)在高温下与A单质反应来得到高纯度的单质E。
则该反应的热化学方程式为:________________________
23、(8分)已知在酸性条件下,亚硝酸根(NO2-)的还原产物为 NO,氧化产物为 NO3-。现有①稀硫酸;②NaOH 溶液;③氨水;④KMnO4溶液;⑤KI淀粉溶液;⑥NaNO2溶液。
请选用合适的试剂来说明NO2-既有氧化性又有还原性。(已知:MnO4-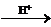 Mn2+)。
Mn2+)。
(1)说明 NO2-有氧化性,应选用的试剂是 (填数字序号),现象是 ,
反应的离子方程式是 。
(2)说明 NO2-有还原性,应选用的试剂是 (填数字序号),现象是 ,反应的离子方程式是 。
22、(10分)现有m g某气体,它由四原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为 mol。
(2)该气体所含原子总数为 个。
(3)该气体在标准状况下的体积为 L。
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为
(5)该气体溶于水后形成V L溶液,其溶液物质的量浓度为 mol·L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com