
23、(11分)某种催化剂为铁的氧化物。化学兴趣小组在实验室对该催化剂中铁元素的价态进行探究:将适量稀硝酸加入少许样品中,加热溶解;取少许溶液,滴加KSCN溶液后出现红色。一位同学由此得出该催化剂中铁元素价态为+3的结论。
(1)请指出该结论是否合理并说明理由 。
(2)请完成对铁元素价态的探究:
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:3 mol·L-1H2SO4、3% H2O2、6 mol·L-1HNO3、0.01 mol·L-1KMnO4、NaOH稀溶液、0.1 mol·L-1Kl、20% KSCN、蒸馏水。
提出合理假设
假设1: ;
假设2: ;
假设3: 。
设计实验方案证明你的假设(不要在答题卡上作答)
实验过程
根据②的实验方案,进行实验。请在答题卡上按下表格式写出实验操作步骤、预期现象与结论。
|
实验操作 |
预期现象与结论 |
|
步骤1: |
|
|
步骤2: |
|
|
步骤3: |
|
|
… |
|
武夷山一中2010-2011学年(上)高三第一次月考
22、(10分)北京市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配 料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
已知Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式
。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
mg/kg。
21、(12分)现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)
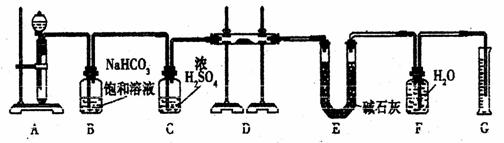
回答下列问题:
(1)装置A中液体试剂选用 ,理由是 。
(2)装置B的作用是 。
装置C的作用是 。
装置E中碱石灰的作用是 。
(3)装置D中发生反应的化学方程式是 。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为 。
20、(6分))有一瓶澄清溶液, 可能含有大量H+、NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO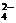 、CO
、CO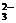 、NO
、NO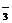 、Cl-、I-,现进行如下实验:
、Cl-、I-,现进行如下实验:




















 (1)测知溶液显强酸性;
(1)测知溶液显强酸性;

 (2)取样加少量四氯化碳和数滴新制氯水、CCl4层为紫红色;
(2)取样加少量四氯化碳和数滴新制氯水、CCl4层为紫红色;

 (3)另取样滴加稀NaOH溶液, 使溶液变为碱性, 此过程无沉淀生成;
(3)另取样滴加稀NaOH溶液, 使溶液变为碱性, 此过程无沉淀生成;

 (4)取少量上述碱性溶液, 加Na2CO3溶液出现白色沉淀;
(4)取少量上述碱性溶液, 加Na2CO3溶液出现白色沉淀;

 (5)将实验(3)中的碱性溶液加热, 有气体放出, 该气体能使湿红色石蕊试纸变蓝。
(5)将实验(3)中的碱性溶液加热, 有气体放出, 该气体能使湿红色石蕊试纸变蓝。

 由此可以推断:
由此可以推断:
溶液中肯定存在的离子有 ;
溶液中肯定不存在的离子有 ;
溶液中不能确定是否存在的离子有 。
19、(6分)实验室配制500ml 0.1 mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取碳酸钠粉末 g。
(2)配制时应选用的仪器有500ml容量瓶,托盘天平、烧杯、药匙、 。
(3)若实验时遇到下列情况,所配溶液的浓度偏大的是 。
A、加水定容时超过刻度线,又吸出少量水至刻度线; B、忘记将洗涤液转入容量瓶;
C、容量瓶洗涤后内壁有水珠而未作干燥处理;
D、称量碳酸钠粉末时左盘放砝码,右盘放药品;
E、定容时俯视刻度线。
18、(4分)(1)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为
(2)氯气与NaOH溶液吸收的离子方程式为
17、含有a mol FeBr2的溶液中,通入x mol Cl2,下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A、x=0.4a,2Fe2++Cl2===2Fe3++2Cl-
B、x=0.6a,2Br-+Cl2===Br2+2Cl-
C、x=a,2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-
D、x=1.5a,2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-
第Ⅱ卷 非选择题(共49分)
16、有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl 离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( )
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( )
A、(y-2x)/a B、(y-x)/a C、(2y-2x)/a D、(2y-4x)/a
15、浓度均为0.1mol·L-1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是( )
A、BaCl2 NaOH NaHCO3 B、Na2CO3 MgCl2 H2SO4
C、AlCl3 NH3·H2O NaOH D、Ba(OH)2 CaCl2 Na2SO4
14、24mL浓度为0.05mol/L的Na2SO3溶液,恰好与20mL浓度为0.02mol/LK2R2O7溶液完全反应,则元素R在被还原的产物中的化合价是( )
A、+6 B、+3 C、+2 D、0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com