
2.3 影响化学反应速率的主要因素
内因:反应的活化能
外因:浓度、温度、催化剂
2、化学反应速率理论
(1)有效碰撞理论
化学反应发生的必要条件是反应物分子(或原子、离子)间的碰撞。
只有极少数活化分子的碰撞才能发生化学反应,称“有效碰撞”;活化分子是反应物分子中能量较高的分子,其比例很小;
理论要点:
※有效碰撞:能发生反应的碰撞;
※ 活化分子:具有较大的动能并且能发生有效碰撞的分子;
※ 活化能:活化分子所具有的最低能量与反应物分子的平均能量之差;
※ 其他条件相同时,活化能越低的化学反应,反应速率越高。
活化能(Ea)是化学反应的“能垒”,Ea越高,反应越慢;Ea越低,反应越快。Ea可以通过实验测定。
一般化学反应的活化能约在40~400 kj.mol-1之间;
多数化学反应的活化能约在60~250 kj.mol-1之间;
反应的活化能小于 40 kj.mol-1时,反应速度很快;
反应的活化能大于 400 kj.mol-1时,反应速度很慢;
中和化学反应的活化能约在13~25 kj.mol-1之间。
(2)过渡状态理论
化学反应并不是通过反应物分子的简单 碰撞完成的,在反应物到产物的转变过程中,先形成一种过渡状态,即反应物分子活化形成配合物的中间状态。

 如 A + BC 「A…B…C」
ABC
如 A + BC 「A…B…C」
ABC
1、化学反应历程(机理)
一个化学反应,在一定条件下,反应物变成生成物实际经过的途径。
基元反应:在反应中反应物分子直接转化成生成物的反应-简单反应。
复杂反应:在反应中反应物分子经过多步才转化成生成物的反应----非基元反应。
基元反应
CO(g) + NO2(g) = CO2(g) + NO(g)
非基元反应
H2(g) + I2(g) = 2HI(g
I2(g) =2 I(g) 快
H2(g) + 2I(g) = 2HI(g) 慢
化学反应速率是指在一定条件下,化学反应中反应物转变为生成物的速率,往往用单位时间内反应物或生成物浓度变化的正值(绝对值)表示,单位:mol.L-1.时间。时间可以为s、min或其他时间单位。
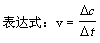
反应速率 =  即
即
通过上式计算得出的实际上是平均速率,当时间间隔趋于0时,平均速率即转化为瞬时速率。如图
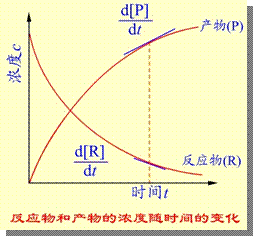
在浓度随时间变化的图上,某时刻的速率即该时刻切线的斜率。以后提到的速率均指瞬时速率。显然,反应刚开始,速率大,然后不断减小,体现了反应速率变化的实际情况。
2.2 化学反应速率理论简介
4.解:显然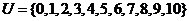 ,由
,由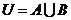 ,
,
得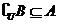 ,即
,即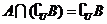 ,而
,而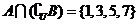 ,
,
得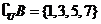 ,而
,而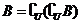 ,
,
即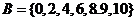 .
.
4.已知全集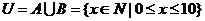 ,
,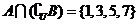 ,试求集合
,试求集合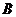 .
.
3.解:显然有集合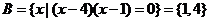 ,
,
当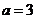 时,集合
时,集合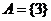 ,则
,则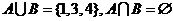 ;
;
当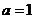 时,集合
时,集合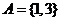 ,则
,则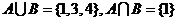 ;
;
当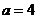 时,集合
时,集合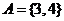 ,则
,则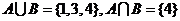 ;
;
当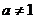 ,且
,且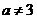 ,且
,且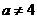 时,集合
时,集合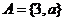 ,
,
则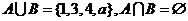 .
.
3.设集合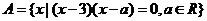 ,
,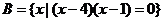 ,求
,求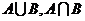 .
.
2.解:集合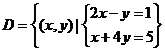 表示两条直线
表示两条直线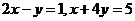 的交点的集合,
的交点的集合,
即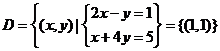 ,点
,点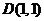 显然在直线
显然在直线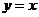 上,
上,
得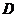
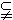
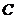 .
.
2.在平面直角坐标系中,集合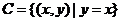 表示直线
表示直线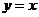 ,从这个角度看,
,从这个角度看,
集合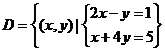 表示什么?集合
表示什么?集合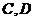 之间有什么关系?
之间有什么关系?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com